
| 1 |
| 100 |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
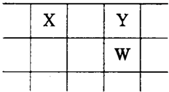 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )| A、五种元素中,X最难形成离子化合物 |
| B、五种元素中,Q的最高价含氧酸的酸性强 |
| C、Y的简单阴离子比W的简单阴离子还原性强 |
| D、Z与Q形成的化合物水溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
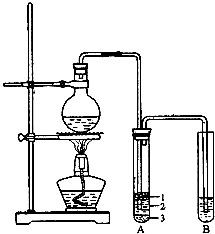 实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定条件下,冰醋酸(纯净的醋酸)加水稀释过程中,溶液的导电能力(I)随加入水的体积(V)变化的曲线如图所示.
在一定条件下,冰醋酸(纯净的醋酸)加水稀释过程中,溶液的导电能力(I)随加入水的体积(V)变化的曲线如图所示.| c(H-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com