
| A. | 容量瓶在使用之前要检漏 | |
| B. | 容量瓶上有温度,浓度,标线三个标识 | |
| C. | 定容时,因不慎使液面高于容量瓶的刻度线,可用滴管将多余液体吸出 | |
| D. | 配置好的溶液储存在容量瓶中,并贴上标签 |
分析 A.容量瓶带有活塞,使用过程中需要上下颠倒,所以使用之前先查漏;
B.依据容量瓶构造解答;
C.定容时,因不慎使液面高于容量瓶的刻度线,导致溶液体积偏大,实验失败必须重新配制;
D.容量瓶为精密仪器,不能长时间存储溶液.
解答 解:A.容量瓶有塞子,使用之前必须先查漏,故A正确;
B.容量瓶上有温度,容积,标线三个标识,故B错误;
C.定容时,因不慎使液面高于容量瓶的刻度线,可用滴管将多余液体吸出,会导致溶质的物质的量偏小,溶液浓度偏低,所以应宣告实验失败,重新配制,故C错误;
D.容量瓶为精密仪器,不能长时间存储溶液,溶液配制完后,应倒入试剂瓶存放,故D错误;
故选:A.
点评 本题考查了仪器的使用方法,熟悉容量瓶构造及使用注意事项是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
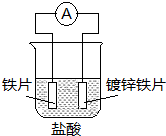
| A. | 溶液中pH值明显下降 | B. | 阴极的电极反应式:Fe-2e→Fe2+ | ||
| C. | 铁片为正极,镀锌铁片为负极 | D. | 电子由锌经溶液流向铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
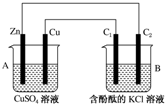 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
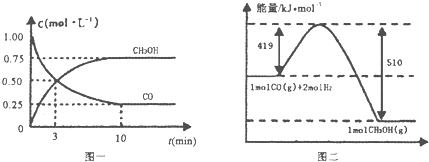
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
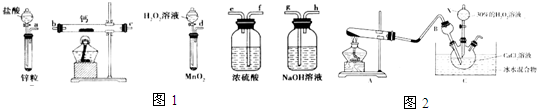
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀铜,表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 铁丝与浓硫酸在常温下钝化 | |
| D. | 在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
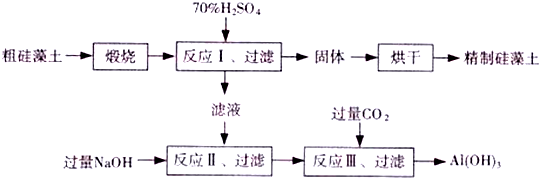
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com