
| A、在标准状况下,11.2L氖气中含有NA个氖原子 |
| B、2 mol?L-1 的Na2SO4溶液中含有4NA个Na+ |
| C、NA个水分子的相对分子质量之和等于水的摩尔质量 |
| D、常温常压下,9克水所含的电子数为5NA |


科目:高中化学 来源: 题型:
| A、在醋酸溶液的PH=a,将此溶液稀释1倍后,溶液的PH=b,则a>b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的PH<7 |
| C、1.0×10-3盐酸的PH=3,1.0×10-8盐酸的PH=8 |
| D、若1mLPH=1的盐酸与100mLNaOH溶液混合后,溶液的PH=7则NaOH溶液的PH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
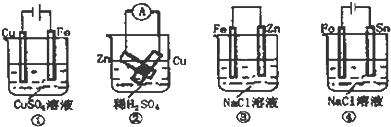
| A、按图①连接并放置一段时间后,Fe片表面会“镀”上一层铜 |
| B、按图②连接好导线后(Zn片与Cu片相接触),灵敏电流表会发生非常明显的偏转 |
| C、按图③连接并放置片刻,在Fe片附近加一滴KSCN溶液,溶液变为深红色 |
| D、按图④连接并放置一段时间后,在Sn片上有无色气泡聚集 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、88.0g 干冰中含有的电子数为8.0NA |
| B、常温下,11.2 L 乙烯在氧气中完全燃烧转移的电子数为6.0NA |
| C、常温下1.0 L 0.1 mol?L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA |
| D、1.2g 金刚石中含有的碳碳键数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
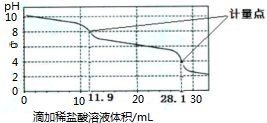
| A、上一个计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ |
| B、下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- |
| C、此样品n(NaHCO3)=(28.1-2×11.9)×10-3 mol |
| D、使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某小组学生想研究不同物质对双氧水分解速率的影响,以生成气体量50mL为标准,设计了如下实验方案:
某小组学生想研究不同物质对双氧水分解速率的影响,以生成气体量50mL为标准,设计了如下实验方案:| 实验序号 | 双氧水体积 | 双氧水浓度 | 添加的物质 | 待测数据X |
| 1 | 100mL | 20% | 无 | |
| 2 | 100mL | 20% | 10gMnO2 | |
| 3 | 100mL | 20% | 10gKI | |
| 4 | 100mL | 20% | 新鲜猪肝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com