
分析 (1)稀硫酸加入氢氧化钡溶液,反应生成硫酸钡和水;
(2)氧化铜和稀硫酸反应生成硫酸铜和水.
解答 解:(1)稀硫酸加入氢氧化钡溶液,反应生成硫酸钡和水,可观察到有白色沉淀生成,反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+H2O,
故答案为:溶液中产生白色沉淀;2H++SO42-+Ba2++2OH-=BaSO4↓+H2O;
(2)氧化铜和稀硫酸反应生成硫酸铜和水,可观察到黑色固体溶解,溶液变为蓝色,反应的离子方程式为2H++CuO=Cu2++H2O,
故答案为:黑色固体溶解,溶液变为蓝色;2H++CuO=Cu2++H2O.
点评 本题考查离子反应,为高频考点,侧重考查学生的分析能力和元素化合物知识,注意把握物质的性质以及离子方程式的书写,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
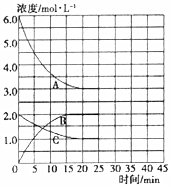 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
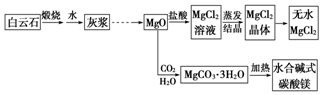 碱式碳酸镁和无水氯化镁具有广泛的用途.用白云石(CaCO3•MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如图:回答问题:
碱式碳酸镁和无水氯化镁具有广泛的用途.用白云石(CaCO3•MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如图:回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液显酸性 | |
| B. | 加热蒸馏水,Kw变大,pH变小 | |
| C. | 常温下,0.01mol•L-1的Ba(OH)2溶液pH为12 | |
| D. | 醋酸溶液加水稀释,所有离子的浓度都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 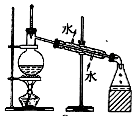 装置常用于分离互不相溶的液体混合物 | |
| B. | 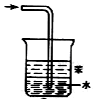 装置可用于吸收氨气,且能防止倒吸 | |
| C. | 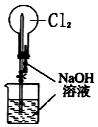 用装置不可以完成“喷泉”实验 | |
| D. | 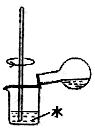 用装置稀释浓硫酸和铜反应冷却后的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+═SO2↑+H2O | |
| D. | 向澄清石灰水中通入过量的二氧化碳:Ca2++2OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂是HCl,氧化剂是MnO2 | |
| B. | 每消耗1 mol HCl,转移电子的物质的量为2 mol | |
| C. | 每生成1 mol Cl2,转移电子的物质的量为2 mol | |
| D. | 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com