
【题目】化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示,下列有关描述正确的是
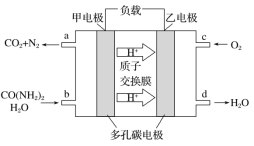
A. 电池工作时H+移向负极
B. 该电池用的电解质溶液是KOH溶液
C. 甲电极反应式:CO(NH2)2+H2O+6e-===CO2+N2+6H+
D. 电池工作时,理论上每净化1 mol CO(NH2)2,消耗标况下氧气33.6 L O2
【答案】D
【解析】
A、原电池中阳离子向正极移动;
B.该原电池是酸性电解质;
C.负极上是CO(NH2)2失电子生成二氧化碳和氮气;
D.根据电池的总反应式进行计算。
A、原电池中阳离子向正极移动,则电池工作时H+移向正极,选项A错误;
B.该原电池是酸性电解质,质子交换膜只允许氢离子通过,选项B错误;
C.负极上是CO(NH2)2失电子生成二氧化碳和氮气,则负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+,选项C错误;
D.电池的总反应式为:2CO(NH2)2+3O2=2CO2+2N2+4H2O,每净化1mol CO(NH2)2,消耗1.5molO2,则在标准状况下氧气为33.6L,选项D正确;
答案选D。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl 3+6NH4HCO3=La2(CO3)3↓+6NH4C1+3CO2↑+3H2O,某化学兴趣小组利用下列实验装置模拟制备碳酸镧。下列说法不正确的是

A.制备碳酸镧实验流程中导管从左向右的连接顺序为:F→A→B→D→E→C
B.Y中发生反应的化学方程式为NH3·H2O+CaO=Ca(OH)2+NH 3↑
C.X中盛放的试剂是饱和NaHCO3溶液,其作用为吸收挥发的HCl,同时生成CO2
D.Z中应先通入CO2,后通入过量的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用某浓度的NaOH溶液滴定20.00mL等浓度的CH3COOH溶液,所得滴定曲线如下图。下列说法正确的是

A. a点醋酸的浓度为1.0×10-3mol·L-1
B. a、b两点对应的醋酸电离平衡常数:a<b
C. c点c(Na+):c(CH3COO-)=1:1
D. d点溶液升高温度,溶液pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH>0。下列叙述正确的是( )
Z(g)+W(s) ΔH>0。下列叙述正确的是( )
A. 加入少量W,逆反应速率增大,正反应速率减小 B. 升高温度,平衡逆向移动
C. 当容器中气体压强不变时,反应达到平衡 D. 反应平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。
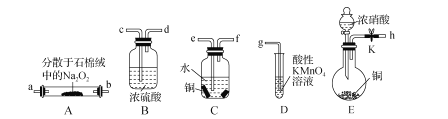
已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO3-;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是_____,检査装置E气密性的方法是_____。
(2)上述实验装置中,依次连接的合理顺序为h-_____。
(3)装置D中酸性KMnO4溶液的作用是_____(用离子方程式表示)。
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为_____。
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入50.00mL0.001mol/L酸性高锰酸钾溶液,充分反应后用0.001mol·L-1草酸钠溶液滴定剩余的高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为_____mg·L-1。若所取样品在空气中放置时间过长,则测定结果_____(填“偏高”“偏低”或“无影响”)。
有关反应如下:
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.20mol·L-1的NaOH溶液滴定10.00mL 0.20mol·L-1的NaHSO3溶液,滴定过程中溶液的pH变化和滴加NaOH溶液的体积关系如图所示。下列说法错误的是( )
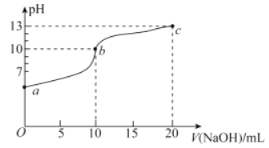
A.溶液中水的电离程度:b>a>c
B.pH=7时,消耗的V(NaOH)<10.00mL
C.在室温下K2(H2SO3)约为1.0×10-7
D.c点溶液中c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化台物肉桂酸甲酯常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,其球棍模型如图所示(图中球与球之间的棍代表化学键,如单键、双键等)。其制备过程涉及肉桂醇电解制备肉桂醛,肉桂醛氧化制备肉非酸,再与甲醇酯化制得。下列说法不正确的是

A. 肉桂酸甲酯的分子式为C10H10O2
B. 电解肉桂醇制得的肉桂醛在电解池的阴极生成
C. 1mol肉桂酸甲酯与H2加成最多消耗4mol
D. 肉桂酸甲酯中所有碳原子可能在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )
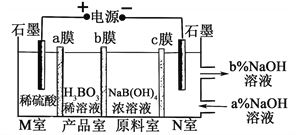
A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置或操作 | 取两支试管各加入4 mL 0.01 mol/L的草酸溶液,分别滴加2 mL 0.1 mol/L、0.2 mol/L的高锰酸钾溶液 |
|
| 向分别盛有5 mL 0.1 mol/L的硫代硫酸钠溶液的试管中滴加5 mL 0.1 mo/L的硫酸溶液,一段时间后,分别放在冷水和热水中。 |
现象 | 褪色并观察褪色的时间 | 左边棉球变黄,右边棉球变蓝 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊且热水中首先出现浑浊 |
结论 | 其他条件不变时,反应物浓度越大,反应速率越快 | 氧化性:Cl2>Br2>I2 | 溶解度:AgCl>AgBr>AgI | 不能说明温度越高,速率越快 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com