
| 37.5% |
| 12 |
| 4.2% |
| 1 |
| 58.3% |
| 16 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
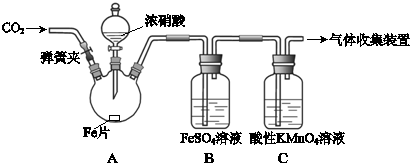
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅.②反应停止后,A中无固体剩余. |
查看答案和解析>>
科目:高中化学 来源: 题型:
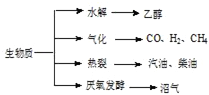
查看答案和解析>>
科目:高中化学 来源: 题型:
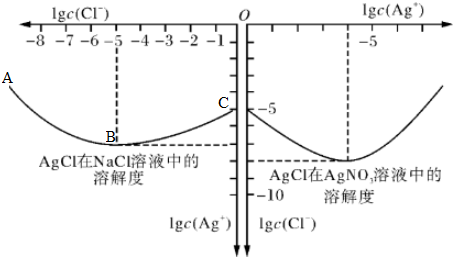
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
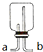 可连接在E处,则Cl2从
可连接在E处,则Cl2从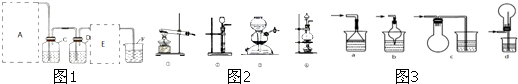
查看答案和解析>>
科目:高中化学 来源: 题型:
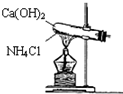 实验室通常用如图所示的装置来制取氨气,(收集装置略).回答下列问题:
实验室通常用如图所示的装置来制取氨气,(收集装置略).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液、蒸馏、萃取 |
| B、蒸发、过滤、分液 |
| C、分液、过滤、加热升华 |
| D、蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硒化氢是无色、有毒、比硫化氢稳定的气体 |
| B、砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 |
| C、硫酸锶难溶于水,但易溶于盐酸 |
| D、铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com