
| A | B | C | D | |
| 电 极 | Zn C | Cu Ag | Zn Cu | Fe Zn |
| 溶 液 | 硫酸 | 硝酸银 | 蔗糖 | 硫酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原电池的形成条件来判断.原电池的形成条件:有两种活泼性不同的金属(或其中一种为非金属导体)作电极;电极均插入电解质溶液中;两极相互连接(或接触);能自发的发生氧化还原反应,据此分析.
解答 解:A、锌是活泼金属,石墨能导电,锌和硫酸能自发的发生氧化还原反应,所以能形成原电池,故A不符合;
B、两金属的活泼性不同,且铜片能自发的与硝酸银发生氧化还原反应,所以能形成原电池,故B不符合;
C、两金属的活泼性不同,但蔗糖是非电解质不能导电,负极不能和电解质溶液发生氧化还原反应,所以不能形成原电池,故C符合;
D、两金属的活泼性不同,且Fe能自发的与硫酸发生氧化还原反应,所以能形成原电池,故D不符合;
故选C.
点评 本题考查原电池的原理,侧重于学生的分析能力的考查,明确电极上发生的反应是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
 室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )
室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )| A. | 0→c段,发生反应的离子方程式为:Al3++4OH-═[Al(OH)4]- | |
| B. | a-b段,溶液pH增大,Al3+浓度不变 | |
| C. | b-c段,加入的OH-主要用于生成Al(OH)3沉淀 | |
| D. | d点时,Al(OH)3沉淀开始溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
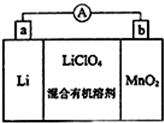 锰及其化合物在现代工业及国防建设中具有十分重要的地位.
锰及其化合物在现代工业及国防建设中具有十分重要的地位.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| B | 将SO2和CO2气体分别通入水中至饱和,立即用pH计测两溶液的pH | 前者的pH小于后者 | H2SO3酸性强于H2CO3 |
| C | 铝热剂溶于足量稀盐酸再滴加KSCN溶液 | 未出现血红色 | 铝热剂中不能确定是否含有铁的氧化物 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入几滴新制Cu(OH)2悬浊液,加热 | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碱式滴定管取23.10mL溴水 | |
| B. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| C. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
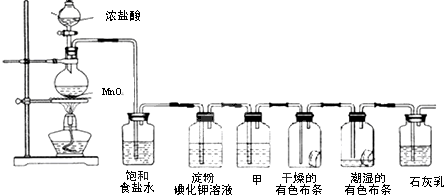
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Fe3+、OHˉ、SO42ˉ | B. | Mg2+、Na+、Clˉ、SO42ˉ | ||
| C. | NH4+、Mg2+、NO3-、OHˉ | D. | H+、K+、NO3-、CO32ˉ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com