
| 离子 | 溶液pH值 | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Cu2+ | 5.2 | 6.4 |
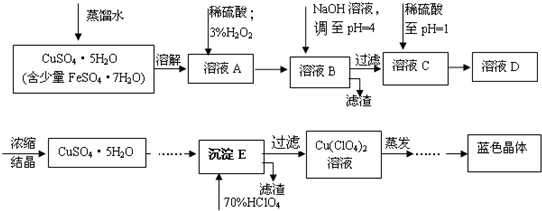
分析 将五水硫酸铜、七水硫酸亚铁溶于水,然后向溶液中加入稀硫酸、3%双氧水,双氧水具有氧化性,能氧化亚铁离子生成铁离子,离子反应方程式为2Fe2++2H++H2O2=2Fe3++2H2O;向溶液B中加入NaOH并调节溶液的pH至4,根据表中数据知,pH=4时铁离子完全转化为沉淀而铜离子不反应,过滤得到的滤渣为Fe(OH)3,滤液C中含有硫酸铜,向滤液C中加入稀硫酸至pH=1得到溶液D,因为硫酸铜易水解生成氢氧化铜,为抑制硫酸铜水解,所以调节溶液的pH至1,将溶液D蒸发浓缩、结晶得到CuSO4•5H2O,过滤得到沉淀E,E为CuSO4•5H2O,将70%高氯酸加入沉淀E中得到高氯酸铜,将高氯酸铜溶液蒸发结晶得到蓝色晶体[Cu(C1O4)2•6H2O],据此分析解答.
解答 解:将五水硫酸铜、七水硫酸亚铁溶于水,然后向溶液中加入稀硫酸、3%双氧水,双氧水具有氧化性,能氧化亚铁离子生成铁离子,离子反应方程式为2Fe2++2H++H2O2=2Fe3++2H2O;向溶液B中加入NaOH并调节溶液的pH至4,根据表中数据知,pH=4时铁离子完全转化为沉淀而铜离子不反应,过滤得到的滤渣为Fe(OH)3,滤液C中含有硫酸铜,向滤液C中加入稀硫酸至pH=1得到溶液D,因为硫酸铜易水解生成氢氧化铜,为抑制硫酸铜水解,所以调节溶液的pH至1,将溶液D蒸发浓缩、结晶得到CuSO4•5H2O,过滤得到沉淀E,E为CuSO4•5H2O,将70%高氯酸加入沉淀E中得到高氯酸铜,将高氯酸铜溶液蒸发结晶得到蓝色晶体[Cu(C1O4)2•6H2O],
(1)根据以上分析知,该离子反应方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(2)硫酸铜易水解生成氢氧化铜和硫酸,为防止硫酸铜水解,可以向溶液中加入少量稀硫酸,所以调节溶液pH=1的目的是防止硫酸铜溶液在蒸发浓缩过程中Cu2+发生水解而得不到纯净的晶体,
故答案为:防止硫酸铜溶液在蒸发浓缩过程中Cu2+发生水解而得不到纯净的晶体;
(3)滤液C中含有的杂质离子为铁离子,铁离子和KSCN溶液混合得到血红色溶液,所以可以用KSCN溶液检验铁离子,其检验方法为取少量溶液,加入KSCN溶液(NH4SCN溶液),观察溶液是否仍然为蓝色,
故答案为:取少量溶液,加入KSCN溶液(NH4SCN溶液),观察溶液是否仍然为蓝色;
(4)蒸发至有晶膜出现,然后经过冷却结晶、过滤、洗涤、低温烘干或自然干燥,温度高时失去结晶水,
故答案为:有晶膜出现;低温烘干 (或自然干燥);
(5)了测定硫酸铜的粗产品的纯度,某同学称量硫酸铜的粗产品2.000g,然后加水溶解、向溶液中加入过量NaOH,过滤、洗涤沉淀、在空气中灼烧,至质量不再改变时,得到的固体是CuO,称得质量为0.6348g,
故答案为:加水溶解;加入过量NaOH(aq);
(6)根据原子守恒得CuSO4.5H2O---CuO,根据关系式知,m(CuSO4.5H2O)=$\frac{0.58816g}{80g/mol}$×250g/mol=1.8385g,其纯度=$\frac{1.8385g}{2g}$×100%=91.9%,测定相对误差=$\frac{91.9%-93.2%}{93.2%}$×100%=-1.4%,
故答案为:91.9%;-1.4%.
点评 本题考查物质制备和物质分离和提纯,为高频考点,侧重考查学生整体分析判断、实验操作等能力,把握物质的性质、物质分离和提纯方法、基本反应计算是解本题关键,注意相对误差的计算方法,题目难度不大.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
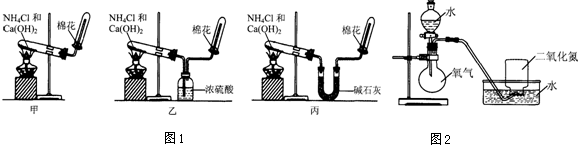
| 实验过程 | 实验现象 | |
| 步骤一 | 将收集满NO2的集气瓶倒立在水槽中. | 集气瓶中液面上升;集气瓶中气体由红棕色变成无色;最终剩余气体约占集气瓶体积的三分之一. |
| 步骤二 | 将分液漏斗中的水逐滴滴入烧瓶,使少量O2进入盛有NO2的集气瓶后,停止滴水. | 集气瓶中气体颜色的变化情况是先由无色变为红棕色,再变成无色;集气瓶中液面继续上升. |
| 步骤三 | 多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,气体不再变成红棕色. | 现象与步骤二相同,最后集气瓶内几乎充满液体,只含极少量气体. |
| 计算 | 用上述实验方法,将标准状况下448mLNO2全部溶于水,得到500mL溶液,则溶液中HNO3的物质的量浓度为0.04mol/L. | |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,A与B可形成另一种气态化合物Z,写出实验室制取Z的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
,A与B可形成另一种气态化合物Z,写出实验室制取Z的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
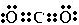 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 蒸馏、分液、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com