
【题目】已知:I2+2 S2O32-![]() S4O62-+2I-。相关物质的溶度积常数见下表:
S4O62-+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl22H2O晶体,加入________;调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________;过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl22H2O晶体。
(2)在空气中直接加热CuCl22H2O晶体得不到纯的无水CuCl2,原因是________________。(用化学方程式表示)。由CuCl22H2O晶体得到纯的无水CuCl2的合理方法是_______________。
(3)某学习小组用“间接碘量法”测定含有CuCl22H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。已知:CuCl2溶液与KI反应的离子方程式为Cu2+ + 4I- = 2CuI↓ + I2
①可选用___________作滴定指示剂,滴定终点的现象是_________________。
②该试样中CuCl22H2O的质量百分数为___________________________。
【答案】 Cu(OH)2或Cu2(OH)2CO3或CuO 2.6×10-9mol/L 2CuCl22H2O![]() Cu2(OH)2CuCl2+2HCl+2H2O 让CuCl22H2O晶体在干燥的HCl气流中加热脱水 淀粉溶液 蓝色褪去,放置一定时间后不恢复原色 95%
Cu2(OH)2CuCl2+2HCl+2H2O 让CuCl22H2O晶体在干燥的HCl气流中加热脱水 淀粉溶液 蓝色褪去,放置一定时间后不恢复原色 95%
【解析】试题分析:(1)加入的物质用于调节pH,主要将铁离子转化为氢氧化铁沉淀,且不能引入新杂质,先根据溶液的pH计算氢离子浓度,再结合水的离子积常数计算氢氧根离子浓度,最后根据Fe(OH)3的Ksp计算铁离子浓度;(2)加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解;(3)依据碘化钾和氯化铜发生氧化还原反应,生成碘化亚铜沉淀和碘单质,碘单质遇淀粉变蓝,依据碘单质被Na2S2O3标准溶液完全还原达到滴定到终点,根据发生反应离子方程式计算。
解析:(1)为得到纯净的CuCl22H2O晶体要除去氯化铁,加入的物质能消耗氢离子,使氢离子浓度减小,氢氧根离子浓度增大,促进氯化铁水解生成氢氧化铁沉淀,且不能引进新的杂质,所以加入物质后应能转化为氯化铜,所以应该加入氢氧化铜或碱式碳酸铜或氧化铜;溶液的pH=4,所以溶液中氢离子浓度为10-4mol/L,则氢氧根离子浓度为10-10mol/L,c(Fe3+)=![]() =2.6×10-9mol/L;(2)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,生成碱式氯化铜或氢氧化铜,而不是CuCl2,2CuCl22H2O
=2.6×10-9mol/L;(2)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,生成碱式氯化铜或氢氧化铜,而不是CuCl2,2CuCl22H2O![]() Cu2(OH)2CuCl2+2HCl+2H2O;想得到无水CuCl2的合理方法是,让CuCl22H2O晶体在干燥的HCl气流中加热脱水;(3)①硫代硫酸钠滴定碘单质反应的方程式是2Na2S2O3+I2═Na2S4O6+2NaI,利用碘单质遇淀粉变蓝选择指示剂为淀粉;终点为蓝色褪去一段时间不恢复颜色;②依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
Cu2(OH)2CuCl2+2HCl+2H2O;想得到无水CuCl2的合理方法是,让CuCl22H2O晶体在干燥的HCl气流中加热脱水;(3)①硫代硫酸钠滴定碘单质反应的方程式是2Na2S2O3+I2═Na2S4O6+2NaI,利用碘单质遇淀粉变蓝选择指示剂为淀粉;终点为蓝色褪去一段时间不恢复颜色;②依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到关系式2Na2S2O3~2Cu2+
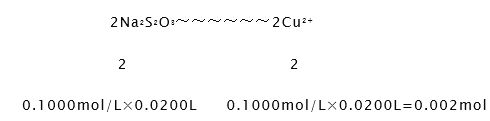
试样中CuCl22H2O的质量百分数为![]() =95%
=95%


科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行如下反应:N2+3H2![]() 2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
A. v(NH3)=0.02mol/(L·min)
B. v(NH3)=0.01mol/(L·min)
C. v(N2)=0.01mol/(L·min)
D. v(H2)=0.03mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为一类物质,下列分类标准不正确的是( )
A.钠的化合物
B.可与硝酸反应
C.可溶于水
D.电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑ ,测得c(FeO42-)在不同条件下变化如图甲、乙、丙、丁所示:
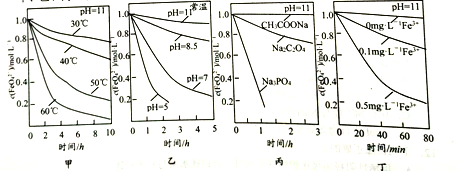
下列说法正确的是
A. 图甲表明,其他条件相同时,温度越低FeO42-转化速率越快
B. 图乙表明,其他条件相同时,碱性越强FeO42-转化速率越快
C. 图丙表明,其他条件相同时,钠盐都是FeO42-优良的稳定剂
D. 图丁表明,其他条件相同时,碱性条件下Fe3+能加快FeO42-的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]是重要的无机化工产品。一种由白云石[主要成分为CaMg(CO3)2,还含少量SiO2、Fe2O3等]为原料制备碱式碳酸镁(国家标准中CaO的质量分数≤0.43%)的实验流程如下:
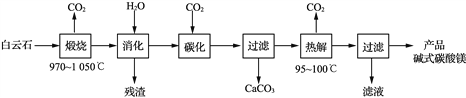
(1) “煅烧”时发生主要反应的化学方程式为____________________________。
(2)常温常压下“碳化”可使镁元素转化为Mg(HCO3)2,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
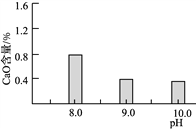
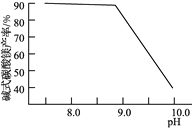
图1 CaO含量与碳化终点pH的关系 图2 碱式碳酸镁产率与碳化终点pH的关系
①应控制“碳化”终点pH约为________,发生的主要反应的化学方程式为______________________和____________________。
②图2中,当pH=10.0时,镁元素的主要存在形式是____________(写化学式)。
(3)“热解”生成碱式碳酸镁的化学方程式为________________________________。
(4)该工艺为达到清洁生产,可以循环利用的物质是____________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(变式探究)已知有以下物质相互转化。
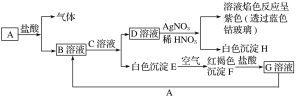
试回答下列问题:
(1)B的化学式为__________,D的化学式为________。
(2)由E转变成F的化学方程式为___________________________。
(3)用KSCN鉴别G溶液的离子方程式为_______________________;
向G溶液加入A的有关反应离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离的是( )
A.Na+、OH﹣、SO42﹣
B.H+、Cl﹣、SO42﹣
C.Na+、K+、OH﹣
D.Na+、K+、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池作为安全性能较好的一类化学电源得到了更快的发展,一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法正确的是
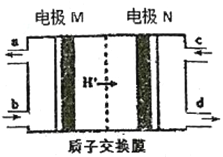
A. 正极的电极反应式为:O2+2H2O+4e-=4OH-
B. 负极上每消耗1molN2H4,会有2molH+通过质子交换膜
C. M极生成氮气且电极附近pH降低
D. d口流出的液体是蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com