
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 0.007 |
| 2 |
| △c |
| △t |
| 0.007 |
| 2 |
| 0.006mol/L |
| 2s |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
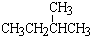 ; ⑧CH3CH2CH2CH3与CH3CH(CH3)2
; ⑧CH3CH2CH2CH3与CH3CH(CH3)2查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积 (mL) |
标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
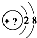 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、假说经过反复验证和修正,才发展成为科学的理论 |
| B、化学模型在研究物质的结构和性质变化时有很重要的作用 |
| C、研究物质的性质常用观察、实验、分类、比较等方法 |
| D、探究物质性质的基本程序是做实验并观察实验现象→分析、解释,得出结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com