
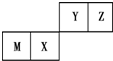
| A. | 原子半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | Z位于元素周期表中第2周期第ⅥA族 |
分析 根据元素周期表中短周期部分的结构和元素位置可知:金属M为Al,X为Si,Y为N,Z为O.
A、同周期自左到右原子半径逐渐减小,同族原子半径逐渐增大;
B、根据非金属性越强,最高价氧化物对应水化物的酸性越强分析;
C、根据非金属性越强,气态氢化物的稳定性越强分析;
D、根据O原子含有2个电子层,最外层含有6个电子分析.
解答 解:根据元素周期表中短周期部分的结构和元素位置可知:金属M为Al,X为Si,Y为N,Z为O.
A、同周期自左到右原子半径逐渐减小,同族原子半径逐渐增大,因此原子半径Al>S>O,故A正确;
B、由于非金属性:N>Si,所以最高价氧化物对应水化物的酸性:HNO3>H2SiO3,故B错误;
C、由于非金属性:O>Si,所以气态氢化物的稳定性:H2O>SiH4,故C正确;
D、O原子含有2个电子层,最外层含有6个电子,因此O位于元素周期表中第二周期、第ⅥA族,故D正确;
故选:B.
点评 本题考查元素周期表及元素周期律的综合应用,通过元素周期表中短周期部分的结构和元素位置推出元素种类,熟悉物质的性质和元素周期律的知识是解题的关键,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 100℃时,KW=10-12,此温度下pH=6的溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHSO3溶液pH=4,说明该溶液中c(HSO3-)>c(SO32-) | |
| C. | NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 | |
| D. | 25℃时,10mL0.1mol/L CH3COOH溶液与5mL 0.1mol/LNaOH溶液混合,所得溶液中有2c(Na+)═c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| B. | 标准状况下,11.2 L CCl4中含有的分子数目为0.5NA | |
| C. | 28 g聚乙烯中含有的碳原子数目为2NA | |
| D. | 1 mol C${{H}_{5}}^{+}$中含有的电子数目为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2气体通入NaOH溶液中,产生倒吸现象,说明SO2极易溶于水 | |
| B. | SO2气体通入溴水中,溴水的颜色褪去,说明SO2具有漂白性 | |
| C. | SO2气体通入酸性KMnO4溶液中,溶液的颜色变浅,说明SO2具有还原性 | |
| D. | SO2气体通入Ba(NO3)2溶液中,溶液出现浑浊现象,说明有BaSO3沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,电解液CuSO4溶液的物质的量浓度不变 | |
| B. | NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液碱性增强 | |
| C. | SO3(g)+H2O(l)═H2SO4(aq)在常温下能自发进行,则该反应的△H<0 | |
| D. | 0.1 mo1•L-1 CH3COOH溶液加水稀释后,溶液中$\frac{{c(CH}_{3}C{OO}^{-1})}{{c(CH}_{3}COOH)}$的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
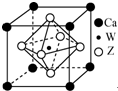 原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为22.
原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为22.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 1 L 1mol/L的盐酸含有NA个HCl分子 | |
| C. | 标准状况下,33.6 L四氯化碳中含有氯原子的数目为6NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
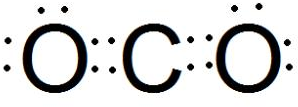 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com