
下列关于Na2CO3和NaHCO3性质的说法错误的是( )
A.热稳定性:NaHCO3<Na2CO3
B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3
C.相同温度时,在水中的溶解性:NaHCO3<Na2CO3
D.等物质的量浓度溶液的pH:NaHCO3<Na2CO3
 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻,如图,则下列说法正确的是( )
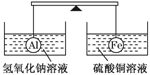
A.两烧杯中均无气泡产生
B.左边烧杯中的溶液质量减少了
C.去掉两烧杯,杠杆仍平衡
D.右边铁球上出现红色
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
| 选项 | 二氧化碳 | 碳酸钠 | 转移的电子 |
| A | 1 mol | 2NA | |
| B | 22.4 L | 1 mol | |
| C | 106 g | 1 mol | |
| D | 106 g | 2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
金属活动性顺序表中K在Na的前面,K与Na在性质上具有很大的相似性。下面是根据Na的性质对K的性质的预测,其中不正确的是( )
A.K在空气中可以被空气中的氧气氧化
B.K可以与乙醇发生反应生成氢气
C.K与水的反应不如钠与水的反应剧烈
D.K也可放在煤油中保存
查看答案和解析>>
科目:高中化学 来源: 题型:
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________g。
(2)钠钾合金可在核反应堆中用作热交换液。5.05 g钠钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
②计算并确定该钠钾合金的化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:
200 ℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均相对分子质量为( )
A.5.8 B.11.6 C.23.2 D.46.4
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子构型的原子中,第二电离能与第一电离能差值最大的是( )
A.1s22s22p5 B.1s22s22p6
C.1s22s22p63s1 D.1s22s22p63s2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C、D是同一周期的非金属元素。A原子的L层p轨道中有2个电子,C是地壳内含量(质量分数)最高的元素,D在元素周期表的各元素中电负性最大,E的原子序数为24。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为____________,D的元素符号是________;
(2)E的元素符号是________,它位于第________周期,它的核外电子排布式为___,在形成化合物时它的最高化合价为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列说法是否正确,正确的划“√”,错误的划“×”
(1)氢键是氢元素与其他元素形成的化学键( )
(2)可燃冰(CH4·8H2O)中甲烷分子与水分子间形成了氢键( )
(3)乙醇分子和水分子间只存在范德华力( )
(4)碘化氢的沸点高于氯化氢的沸点是因为碘化氢分子间存在氢键( )
(5)水分子间既存在范德华力,又存在氢键( )
(6)氢键具有方向性和饱和性( )
(7)H2和O2之间存在氢键( )
(8)H2O2分子间存在氢键( )
(9)卤素单质、卤素氢化物、卤素碳化物(即CX4)的熔、沸点均随着相对分子质量的增大而增大( )
(10)氢键的存在一定能使物质的熔、沸点升高( )
(11)极性分子中可能含有非极性键( )
(12)H2O比H2S稳定是因为水分子间存在氢键( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com