
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
下列化学用语的使用正确的是
A.硫酸酸化的淀粉KI溶液在空气中变成蓝色:4I-+O2+2H2O==2I2+4OH-
 B.钢铁发生吸氧腐蚀时,正极的电极反应式:O2+4e-+2H2O==4OH-
B.钢铁发生吸氧腐蚀时,正极的电极反应式:O2+4e-+2H2O==4OH-
C.氨气催化氧化生产硝酸的主要反应: 4NH3+3O2 2N2↑+6H2O
D.向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O===H2SiO3+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。
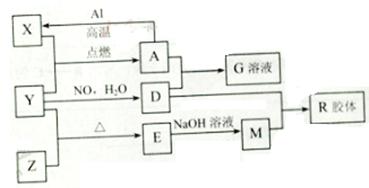
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是 ;M中存在的化学键类型为 ;R的化学式是 。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为 。
(3)已知A与1molAl反应转化为X时(所有物质均为固体)。放出aKJ热量。写出该反应的热化学方程式:
。
(4)写出A和D的稀溶液反应生成G的离子方程式:
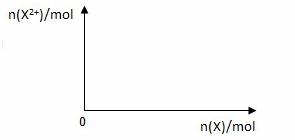
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和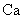 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数)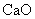 .
.
(1)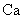 元素在周期表中位置是 ,其原子结构示意图 .
元素在周期表中位置是 ,其原子结构示意图 .
(2)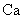 与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与
与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与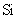 形成的化合物E的沸点 .
形成的化合物E的沸点 .
(3)配平用钙线氧脱鳞的化学方程式:
P+ FeO+ CaO
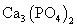 + Fe
+ Fe
(4)将钙线试样溶于稀盐酸后,加入过量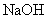 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色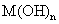 .则金属M为______;检测
.则金属M为______;检测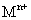 的方法是_____(用离子方程式表达).
的方法是_____(用离子方程式表达).
(5)取1.6g钙线试样,与水充分反映,生成224ml.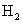 (标准状况),在想溶液中通入适量的
(标准状况),在想溶液中通入适量的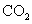 ,最多能得到
,最多能得到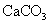 g.
g.
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应。X的原子结构示意图为________。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为__________________________。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y单质的电子式为____________;Z分子的结构呈____________。
②A的化学式是________________________。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于下列常见化学物质的认识错误的是( )
A.明矾可用作净水剂
B.干冰能用于人工降雨
C.碳酸钙是文物陶瓷的主要成分
D.小苏打是一种膨松剂,可用于制作馒头和面包
查看答案和解析>>
科目:高中化学 来源: 题型:
如何防止铁的腐蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 | 内容 | 实验现象 |
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号)_______________;在电化学腐蚀中,负极反应是_______________;正极反应是_______________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是_______________;
(3)为防止铁的锈蚀,工业上普遍采用的方法是_______________(答两种方法)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
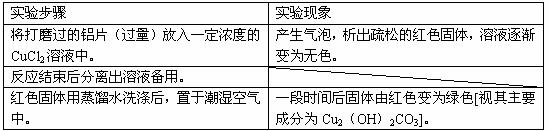
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应____________________________________________________________;
化合反应____________________________________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。
持续电解,在阴极附近的溶液中还可观察到的现象是__________________________ __________________________________。
解释此现象的离子方程式是________________________、_________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)
____________________________________________________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
重金属离子具有毒性.实验室中有甲、乙两种重金属离子的废液,甲废液经化验呈碱性,主要有毒离子为Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低.则乙废液中可能含有的离子是( )
|
| A. | Cu2+和SO42﹣ | B. | Cu2+和Cl﹣ | C. | K+和SO42﹣ | D. | Ag+和NO3﹣ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com