
室温时,向20 mL 0.1 mol·L-1的醋酸溶液中不断滴入0.1 mol·L-1的NaOH溶液,溶液的pH变化曲线,如图2所示。在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
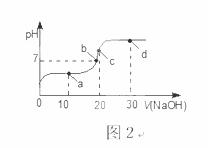
A.a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -)
B.b点时:c( Na+) =c( CH3COO-)>c(H+)=c( OH-)
C.c点时:c(OH-)=c(CH3COOH) +c(H+)
D.d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【答案】A
【解析】a点时醋酸过量,溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,应存在c(CH3COO-)>c(CH3COOH),错误;B.根据溶液电荷守恒可知溶液中应存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性,应有c(H+)=c(OH-),则c(Na+)=c(CH3COO-),c( Na+) =c( CH3COO-)>c(H+)=c( OH-),正确;C.c点时,溶液呈碱性,应有c(OH-)=c(CH3COOH) +c(H+),正确;D.d点为NaOH和CH3COONa的混合物,溶质为0.002mol的醋酸钠和0.001mol的氢氧化钠,溶液呈碱性,由于CH3COO-存在微弱的水解,则有c(Na+)>c(CH3COO-)>c(OH-)>c(H+),正确,选A。


科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法中,不正确的是
A.钢铁在潮湿空气中生锈属于电化学腐蚀
B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀
C.金属腐蚀的本质是金属原子失去电子被氧化的过程
D.铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+ H2O(g) CO2(g)+ H2(g) ; △H <0反应达到平衡后,为提高CO的转化率,下列措施中正确的是
CO2(g)+ H2(g) ; △H <0反应达到平衡后,为提高CO的转化率,下列措施中正确的是
A.增加压强 B.降低温度
C.增大H2O(g) 的浓度 D.更换催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH 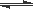 CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
A.温度升高,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量醋酸钠固体,CH3COOH溶液的电离度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
A. 0.05 mol/L B.0.07 mol/L C. 0.01 mol/L D.0.50 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)=2Fe (s)+3CO(g) ΔH 1=+489.0 kJ· mol-1,
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1, 则CO还原Fe2O3(s)的热化学方程式为 。
(2)CO与O2设计成燃料电池(以KOH溶液为电解液)。该电池的负极反应式为 。
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g) 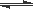 CH3OH(g) +H2O(g) 测得CH3OH的物质的量随时间的变化如图5。
CH3OH(g) +H2O(g) 测得CH3OH的物质的量随时间的变化如图5。
|

①该反应的ΔH 0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为
KⅠ KⅡ (填“>、=或<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2、3 mol H2 | a molCO2、3a molH2、 b molCH3OH(g)、b molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如图6。在0~15小时内,CH4的平均生成速率I、II和III从小到大的顺序为 (填序号)。
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图7。
①当温度在 范围时,温度是乙酸生成速率的主要影响因素。
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列涉及有机物的性质或应用的说法不正确的是( )
A.干馏煤可以得到甲烷、苯和氨等重要化工原料
B.用于奥运“祥云”火炬的丙烷是一种清洁燃料
C.用大米酿的酒在一定条件下密封保存,时间越长越香醇
D.纤维素、蔗糖、葡萄糖和脂肪在一起条件下都可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2SO2 (g) + O2 (g) 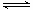 2SO3 (g) ΔH = -197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2 (乙) 1 mol SO2和0.5 mol O2 (丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3 (g) ΔH = -197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2 (乙) 1 mol SO2和0.5 mol O2 (丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙 > 2P乙
B.SO3的质量m:m甲=m丙 > 2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙 > k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙 > 2Q乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com