
| 选项 | 实验现象 | 原因分析 |
| A | 浓硫化钠溶液有臭味 | 硫离子水解生成硫化氢,硫化氢具有臭味 |
| B | 新制氯水中滴加石蕊试液,溶液先变红,后褪色 | 氯气与水反应生成HCl、HClO,HCl显强酸性,使石蕊变红,HClO具有强氧化性,使其褪色 |
| C | SO 2通入溴水中,溴水褪色 | SO 2具有漂白性,使其褪色 |
| D | 向饱和Na2CO3溶液中通入足量CO2气体,溶液变浑浊 | 析出了NaHCO3晶体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硫离子能够水解生成硫化氢,硫化氢具有臭味;
B.氯水中含有盐酸和次氯酸,溶液具有酸性与强氧化性;
C.二氧化硫的漂白性指与有机色质化合为无色物质,而与溴水发生氧化还原反应;
D.碳酸氢钠的溶解度较小,碳酸钠溶液与二氧化碳反应生成溶解度减小的碳酸氢钠.
解答 解:A.由于硫离子水解生成硫化氢,硫化氢具有臭味,所以浓硫化钠溶液有臭味,该分析合理,故A不选;
B.氯水中含有盐酸和次氯酸,溶液呈酸性,加入石蕊,溶液变红,次氯酸具有强氧化性,氧化有色物质为无色,而使其褪色,该实验现象的原因分析合理,故B不选;
C.SO2通入溴水中,溴水褪色,体现二氧化硫的还原性,实验现象的原因分析不合理,故C选;
D.向饱和Na2CO3溶液中通入足量CO2气体,碳酸钠与二氧化碳反应生成碳酸氢钠,碳酸氢钠的溶解度小于碳酸钠,所以会析出NaHCO3晶体,导致溶液变浑浊,该分析可知,故D不选;
故选C.
点评 本题考查化学实验方案的评价,涉及盐的水解原理、二氧化硫性质、碳酸钠和碳酸氢钠的性质、氯水的性质等知识,侧重对物质的性质的考查,题目难度中等,注意氯水的成分和性质.


科目:高中化学 来源: 题型:解答题
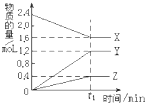 I.某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
I.某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示: 3Y+Z.
3Y+Z.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
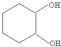 ,其过程如下:
,其过程如下: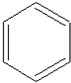 $→_{FeBr_{3}}^{Br_{2}}$A$→_{Ni△}^{H_{2}}$→C→D→
$→_{FeBr_{3}}^{Br_{2}}$A$→_{Ni△}^{H_{2}}$→C→D→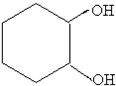
 ;
;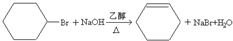 ;
; ;
;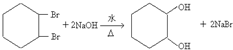 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜基态原子核外电子排布式为1s22s22p63s23p64s13d10 | |
| B. | 在d轨道中电子排布成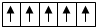 而不是 而不是 ,其最直接的根据是泡利原理 ,其最直接的根据是泡利原理 | |
| C. | 下列轨道的能量是按由高到低排列的E5s>E4s>E3d>E2p>E1s | |
| D. | 焰色反应、激光、霓虹灯光等与原子核外电子发生跃迁释放能量有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com