
| 晶体 | NaCl | KCl | AlCl3 | SiCl4 | 单质B |
| 熔点/℃ | 810 | 776 | 190 | -68 | 2300 |
| 沸点/℃ | 1465 | 1418 | 180 | 57 | 2500 |
| A. | SiCl4是分子晶体 | B. | 单质B可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | NaCl中化学键的强度比KCl中的小 |
分析 A.根据SiCl4的物理性质分析;
B.根据单质B的熔沸点分析;
C.由表中数据可知AlCl3的沸点比熔点低;
D.离子晶体的晶格能越大,化学键强度越高.
解答 解:A.由表中数据可知,SiCl4的熔沸点较低,属于分子晶体,故A正确;
B.单质B的熔沸点很高,所以单质B是原子晶体,故B正确;
C.由表中数据可知AlCl3的沸点比熔点低,所以AlCl3加热能升华,故C正确;
D.KCl、NaCl均为离子晶体,决定晶格能的因素为:离子电荷、离子半径,钾离子的半径大于钠离子,所带电荷相同,因此NaCl的晶格能较大,化学键强度较大,故D错误;
故选D.
点评 本题主要考查了不同类型晶体的熔沸点高低及决定熔沸点的因素,注意离子晶体晶格能大的熔点高,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一主族的元素称为碱金属 | |
| B. | 第二周期元素的最高化合价依次递增,并等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNaOD溶于重水制成1L溶液,pD=13 | |
| B. | 将pD=4的DCl的重水溶液稀释100倍,所得溶液pD不等于6 | |
| C. | 向30mL0.5mol•L-1NaOD的重水溶液中加入20mL0.5mol•L-1DCl的重水溶液,所得溶液pD=11 | |
| D. | pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
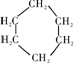 .若该有机物M能使溴水褪色,且所有碳原子共面,则M的结构简式为(CH3)2C=C(CH3)2.
.若该有机物M能使溴水褪色,且所有碳原子共面,则M的结构简式为(CH3)2C=C(CH3)2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
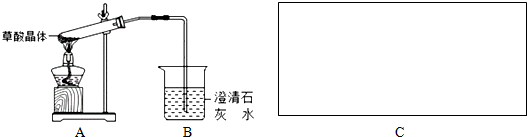

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com