
£Ø13·Ö£©æĘѧ¼ŅĄūÓĆĢ«ŃōÄÜ·Ö½āĖ®Éś³ÉµÄĒāĘųŌŚ“߻ƼĮ×÷ÓĆĻĀÓė¶žŃõ»ÆĢ¼·“Ӧɜ³É¼×“¼”£ŅŃÖŖH2(g)”¢CO(g)ŗĶCH3OH(l)µÄČ¼ÉÕČČ”÷H·Ö±šĪŖ−285.8kJ”¤mol-1”¢−283.0kJ”¤mol-1ŗĶ−726.5kJ”¤mol-1”£
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)³£ĪĀĻĀÓĆĢ«ŃōÄÜ·Ö½ā10molŅŗĢ¬Ė®ĻūŗĵÄÄÜĮæŹĒ_____________kJ£»
(2)¼×“¼²»ĶźČ«Č¼ÉÕÉś³ÉŅ»Ńõ»ÆĢ¼ŗĶŅŗĢ¬Ė®µÄČČ»Æѧ·½³ĢŹ½ĪŖ___________£»
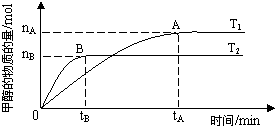
(3)ŌŚČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ£¬ÓÉCOŗĶH2ŗĻ³É¼×“¼£¬ŌŚĘäĖūĢõ¼ž²»±äµÄĒéæöĻĀ£¬æ¼²éĪĀ¶Č¶Ō·“Ó¦µÄÓ°Ļģ£¬ŹµŃé½į¹ūČēÓŅĶ¼ĖłŹ¾£Ø×¢£ŗT1”¢T2¾ł“óÓŚ300”ę£©£»ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ_______£ØĢīŠņŗÅ£©
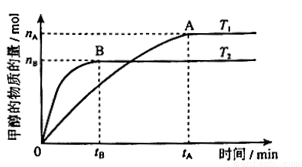
¢ŁĪĀ¶ČĪŖT1Ź±£¬“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬Éś³É¼×“¼µÄĘ½¾łĖŁĀŹĪŖv(CH3OH)= 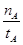 mol”¤L-1”¤min-1
mol”¤L-1”¤min-1
¢ŚøĆ·“Ó¦ŌŚT1Ź±µÄĘ½ŗā³£Źż±ČT2Ź±µÄŠ”
¢ŪøĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦
¢Ü“¦ÓŚAµćµÄ·“Ó¦ĢåĻµ“ÓT1±äµ½T2£¬“ļµ½Ę½ŗāŹ±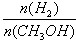 Ōö“ó
Ōö“ó
(1)2858 £Ø4·Ö£©(2) CH3OH(l)+O2(g)=CO(g)+2H2O(l) ”÷H =-443.5kJ”¤mol-1 £Ø5·Ö£©
(3)¢Ū¢Ü £Ø4·Ö£©
”¾½āĪö”æ£Ø1£©øł¾ŻĒāĘųµÄČ¼ÉÕČČæÉÖŖ£¬·Ö½ā10molĖ®ŠčŅŖµÄÄÜĮæŹĒ285.8kJ”¤mol-1”Į10mol£½2858kJ”£
£Ø2£©COŗĶ¼×“¼ĶźČ«Č¼Éյķ½³ĢŹ½·Ö±šĪŖ¢ŁCO(g)£«1/2O2(g)=CO2(g) ”÷H£½−283.0kJ”¤mol-1”¢¢ŚCH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ”÷H =−726.5kJ”¤mol-1”£øł¾ŻøĒĖ¹¶ØĀÉæÉÖŖ£¬¢Ś£¢Ł¼“µĆµ½CH3OH(l)+O2(g)=CO(g)+2H2O(l)£¬ĖłŅŌ”÷H£½−726.5kJ”¤mol-1£«283.0kJ”¤mol-1£½£443.5kJ”¤mol-1”£
£Ø3£©CO2ŗĶH2ŗĻ³É¼×“¼µÄ»Æѧ·½³ĢŹ½ĪŖCO2(g)£«3H2(g) CH3OH(g) + H2O(g)”£ÓÉĶ¼ĻńæÉÖŖBĒśĻßĻȵƵ½Ę½ŗā£¬Ņņ“ĖĪĀ¶ČT2£¾T1£¬ĪĀ¶ČøßĘ½ŗāŹ±¼×“¼µÄĪļÖŹµÄĮæ·“¶ųµĶ£¬ĖµĆ÷Õż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬²»ĄūÓŚ¼×“¼µÄÉś³É£¬Ę½ŗā³£Źż¼õŠ”£¬¼“¢Ś“ķ¢ŪÕżČ·£»ĪĀ¶ČĪŖT1Ź±£¬“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬Éś³É¼×“¼µÄĪļÖŹµÄĮæĪŖ
CH3OH(g) + H2O(g)”£ÓÉĶ¼ĻńæÉÖŖBĒśĻßĻȵƵ½Ę½ŗā£¬Ņņ“ĖĪĀ¶ČT2£¾T1£¬ĪĀ¶ČøßĘ½ŗāŹ±¼×“¼µÄĪļÖŹµÄĮæ·“¶ųµĶ£¬ĖµĆ÷Õż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬²»ĄūÓŚ¼×“¼µÄÉś³É£¬Ę½ŗā³£Źż¼õŠ”£¬¼“¢Ś“ķ¢ŪÕżČ·£»ĪĀ¶ČĪŖT1Ź±£¬“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬Éś³É¼×“¼µÄĪļÖŹµÄĮæĪŖ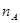 mol£¬“ĖŹ±¼×“¼µÄÅضČĪŖ
mol£¬“ĖŹ±¼×“¼µÄÅضČĪŖ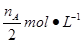 £¬ĖłŅŌÉś³É¼×“¼µÄĘ½¾łĖŁĀŹĪŖ£ŗv(CH3OH)=
£¬ĖłŅŌÉś³É¼×“¼µÄĘ½¾łĖŁĀŹĪŖ£ŗv(CH3OH)=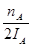 mol”¤L-1”¤min-1£¬Ņņ“Ė¢Ł²»ÕżČ·£»ŅņĪŖĪĀ¶ČT2£¾T1£¬ĖłŅŌAµćµÄ·“Ó¦ĢåĻµ“ÓT1±äµ½T2Ź±£¬Ę½ŗā»įĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬¼“½µµĶÉś³ÉĪļÅØ¶Č¶ųŌö“ó·“Ó¦ĪļÅØ¶Č£¬ĖłŅŌ¢ÜÕżČ·”£“š°øŃ”)¢Ū¢Ü”£
mol”¤L-1”¤min-1£¬Ņņ“Ė¢Ł²»ÕżČ·£»ŅņĪŖĪĀ¶ČT2£¾T1£¬ĖłŅŌAµćµÄ·“Ó¦ĢåĻµ“ÓT1±äµ½T2Ź±£¬Ę½ŗā»įĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬¼“½µµĶÉś³ÉĪļÅØ¶Č¶ųŌö“ó·“Ó¦ĪļÅØ¶Č£¬ĖłŅŌ¢ÜÕżČ·”£“š°øŃ”)¢Ū¢Ü”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
 £Ø2011?½Ī÷£©æĘѧ¼ŅĄūÓĆĢ«ŃōÄÜ·Ö½āĖ®Éś³ÉµÄĒāĘųŌŚ“߻ƼĮ×÷ÓĆĻĀÓė¶žŃõ»ÆĢ¼·“Ӧɜ³É¼×“¼£¬²¢æŖ·¢³öÖ±½ÓŅŌ¼×“¼ĪŖČ¼ĮĻµÄČ¼ĮĻµē³Ų£®ŅŃÖŖH2£Øg£©”¢CO£Øg£©ŗĶCH3OH£Øl£©µÄČ¼ÉÕČČ”÷H·Ö±šĪŖ-285.8kJ?mol-1”¢-283.0kJ?mol-1ŗĶ-726.5kJ?mol-1£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø2011?½Ī÷£©æĘѧ¼ŅĄūÓĆĢ«ŃōÄÜ·Ö½āĖ®Éś³ÉµÄĒāĘųŌŚ“߻ƼĮ×÷ÓĆĻĀÓė¶žŃõ»ÆĢ¼·“Ӧɜ³É¼×“¼£¬²¢æŖ·¢³öÖ±½ÓŅŌ¼×“¼ĪŖČ¼ĮĻµÄČ¼ĮĻµē³Ų£®ŅŃÖŖH2£Øg£©”¢CO£Øg£©ŗĶCH3OH£Øl£©µÄČ¼ÉÕČČ”÷H·Ö±šĪŖ-285.8kJ?mol-1”¢-283.0kJ?mol-1ŗĶ-726.5kJ?mol-1£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ| nA |
| tA |
| n(H2) |
| n(CH3OH) |
| 2-a |
| 2 |
| 2-a |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 æĘѧ¼ŅĄūÓĆĢ«ŃōÄÜ·Ö½āĖ®Éś³ÉµÄĒāĘųŌŚ“߻ƼĮ×÷ÓĆĻĀÓė¶žŃõ»ÆĢ¼·“Ӧɜ³É¼×“¼£®ŅŃÖŖH2£Øg£©”¢CO£Øg£©ŗĶCH3OH£Øl£©µÄČ¼ÉÕČČ”÷H·Ö±šĪŖ-285.8kJ?mol-1”¢-283.0kJ?mol-1ŗĶ-726.5kJ?mol-1£®
æĘѧ¼ŅĄūÓĆĢ«ŃōÄÜ·Ö½āĖ®Éś³ÉµÄĒāĘųŌŚ“߻ƼĮ×÷ÓĆĻĀÓė¶žŃõ»ÆĢ¼·“Ӧɜ³É¼×“¼£®ŅŃÖŖH2£Øg£©”¢CO£Øg£©ŗĶCH3OH£Øl£©µÄČ¼ÉÕČČ”÷H·Ö±šĪŖ-285.8kJ?mol-1”¢-283.0kJ?mol-1ŗĶ-726.5kJ?mol-1£®| nA |
| tA |
| nA |
| tA |
| a |
| 2 |
| a |
| 2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 æĘѧ¼ŅĄūÓĆĢ«ŃōÄÜ·Ö½āĖ®Éś³ÉµÄĒāĘųŌŚ“߻ƼĮ×÷ÓĆĻĀÓė¶žŃõ»ÆĢ¼·“Ӧɜ³É¼×“¼£¬²¢æŖ·¢³öÖ±½ÓŅŌ¼×“¼ĪŖČ¼ĮĻµÄČ¼ĮĻµē³Ų£®ŅŃÖŖH2£Øg£©”¢CO£Øg£©ŗĶCH3OH£Øl£©µÄČ¼ÉÕČČ”÷H·Ö±šĪŖ-285.8kJ?mol-1”¢-283.0kJ?mol-1ŗĶ-726.5kJ?mol-1£®
æĘѧ¼ŅĄūÓĆĢ«ŃōÄÜ·Ö½āĖ®Éś³ÉµÄĒāĘųŌŚ“߻ƼĮ×÷ÓĆĻĀÓė¶žŃõ»ÆĢ¼·“Ӧɜ³É¼×“¼£¬²¢æŖ·¢³öÖ±½ÓŅŌ¼×“¼ĪŖČ¼ĮĻµÄČ¼ĮĻµē³Ų£®ŅŃÖŖH2£Øg£©”¢CO£Øg£©ŗĶCH3OH£Øl£©µÄČ¼ÉÕČČ”÷H·Ö±šĪŖ-285.8kJ?mol-1”¢-283.0kJ?mol-1ŗĶ-726.5kJ?mol-1£®| nA |
| tA |
| n(H2) |
| n(CH3OH) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 æĘѧ¼ŅĄūÓĆĢ«ŃōÄÜ·Ö½āĖ®Éś³ÉµÄĒāĘųŌŚ“߻ƼĮ×÷ÓĆĻĀÓė¶žŃõ»ÆĢ¼·“Ӧɜ³É¼×“¼£¬²¢æŖ·¢³öÖ±½ÓŅŌ¼×“¼ĪŖČ¼ĮĻµÄČ¼ĮĻµē³Ų£®ŅŃÖŖH2£Øg£©”¢CO£Øg£©ŗĶCH3OH£Øl£©µÄČ¼ÉÕČČ”÷H·Ö±šĪŖ-285.8kJ?mol-1”¢-283.0kJ?mol-1ŗĶ-726.5kJ?mol-1£®
æĘѧ¼ŅĄūÓĆĢ«ŃōÄÜ·Ö½āĖ®Éś³ÉµÄĒāĘųŌŚ“߻ƼĮ×÷ÓĆĻĀÓė¶žŃõ»ÆĢ¼·“Ӧɜ³É¼×“¼£¬²¢æŖ·¢³öÖ±½ÓŅŌ¼×“¼ĪŖČ¼ĮĻµÄČ¼ĮĻµē³Ų£®ŅŃÖŖH2£Øg£©”¢CO£Øg£©ŗĶCH3OH£Øl£©µÄČ¼ÉÕČČ”÷H·Ö±šĪŖ-285.8kJ?mol-1”¢-283.0kJ?mol-1ŗĶ-726.5kJ?mol-1£®| nA |
| tA |
| n(H2) |
| n(CH3OH) |
| 2-a |
| 2 |
| 2-a |
| 2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 Ģ¼ŹĒ»ÆŗĻĪļÖÖĄą×ī¶ąµÄŌŖĖŲ£¬Ę䵄֏¼°»ÆŗĻĪļŹĒČĖĄąÉś²śÉś»īµÄÖ÷ŅŖÄÜŌ“ĪļÖŹ£®
Ģ¼ŹĒ»ÆŗĻĪļÖÖĄą×ī¶ąµÄŌŖĖŲ£¬Ę䵄֏¼°»ÆŗĻĪļŹĒČĖĄąÉś²śÉś»īµÄÖ÷ŅŖÄÜŌ“ĪļÖŹ£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com