
| 平衡移动方向 | C(Al3+) | n(H+) | c(H+) | |
| 通入HCl | ||||
| 加少量NaOH | ||||
| 加少量Na2CO3 | ||||
| 加水稀释 | ||||
| 升高温度 |
分析 在AlCl3溶液中存在着平衡体系:Al3+3H2O?Al(OH)3+3H+.
通入HCl,增大了c(H+),平衡左移,据此分析;
加少量NaOH,使c(H+)减小,平衡右移,据此分析;
加少量Na2CO3,反应掉了H+,使c(H+)减小,平衡右移,据此分析;
盐越稀越水解,即加水促进盐的水解;
盐的水解吸热.
解答 解:在AlCl3溶液中存在着平衡体系:Al3+3H2O?Al(OH)3+3H+.
通入HCl,增大了c(H+),平衡左移,n(H+)增大,C(Al3+)增大;
加少量NaOH,使c(H+)减小,平衡右移,n(H+)减小,C(Al3+)减小;
加少量Na2CO3,反应掉了H+,使c(H+)减小,平衡右移,n(H+)减小,C(Al3+)减小;
盐越稀越水解,即加水促进盐的水解,即平衡右移,n(H+)增大,但由于加水导致溶液体积增大,故c(H+)减小,C(Al3+)减小;
盐的水解吸热,故升高温度,平衡右移,水解出的n(H+)增大,c(H+)增大,C(Al3+)减小.
故答案为:
| 平衡移动方向 | C(Al3+) | n(H+) | c(H+) | |
| 通入HCl | 向左 | 增大 | 增大 | 增大 |
| 加少量NaOH | 向右 | 减小 | 减小 | 减小 |
| 加少量Na2CO3 | 向右 | 减小 | 减小 | 减小 |
| 加水稀释 | 向右 | 减小 | 增大 | 减小 |
| 升高温度 | 向右 | 减小 | 增大 | 增大 |
点评 本题考查盐类水解平衡的移动,注意根据平衡移动和溶液体积的变化来分析溶液中离子浓度变化,题目难度中等.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将wg a%的NaCl溶液蒸发掉w/2g水,得到2a%的NaCl溶液 | |
| B. | 将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L | |
| C. | 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L | |
| D. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用NaOH溶液滴定10mL盐酸,滴定过程中溶液的pH变化如图.NaOH溶液和盐酸的物质的量浓度(单位:mol•L-1)分别为( )
用NaOH溶液滴定10mL盐酸,滴定过程中溶液的pH变化如图.NaOH溶液和盐酸的物质的量浓度(单位:mol•L-1)分别为( )| A. | 0.12,0.04 | B. | 0.04,0.12 | C. | 0.12,0.06 | D. | 0.03,0.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 30% | C. | 45% | D. | 55% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
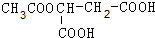 +H2O.
+H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol•L-1•min-1 | B. | 0.9 mol•L-1•min-1 | ||
| C. | 1.2 mol•L-1•min-1 | D. | 1.8 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com