
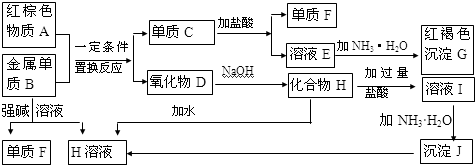
分析 金属B与强碱反应得到单质F与H,则B为Al、F为H2,H为偏铝酸盐,G为红褐色沉淀,则G为Fe(OH)3,红棕色物质A与金属Al发生置换反应生成单质C与氧化物D,则A为Fe2O3、C为Fe、D为Al2O3,由转化关系可知,E为FeCl2,H为NaAlO2,溶液I为NaCl、HCl、AlCl3混合物,J为Al(OH)3,据此解答.
解答 解:金属B与强碱反应得到单质F与H,则B为Al、F为H2,H为偏铝酸盐,G为红褐色沉淀,则G为Fe(OH)3,红棕色物质A与金属Al发生置换反应生成单质C与氧化物D,则A为Fe2O3、C为Fe、D为Al2O3,由转化关系可知,E为FeCl2,H为NaAlO2,溶液I为NaCl、HCl、AlCl3混合物,J为Al(OH)3.
(1)由上述分析可知,单质F的化学式是H2,物质A为Fe2O3,可以用作油漆颜料,炼铁等,
故答案为:H2;用作油漆颜料,炼铁等;
(2)单质Al与强碱溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,由沉淀J生成 H溶液的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al(OH)3+OH-=AlO2-+2H2O;
(3)溶液FeCl2中加入氨水时,先生成白色沉淀L为Fe(OH)2,离子方程式:Fe2++2OH-=Fe(OH)2↓,白色沉淀会迅速变为灰绿色,最终变为红褐色沉淀,L变为G的化学反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)溶液I为NaCl、HCl、AlCl3混合物,所含金属离子是Na+、Al3+,故答案为:Na+、Al3+.
点评 本题考查无机物推断,物质的颜色及转化关系中特殊反应是推断突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个18O2和NA个NO的质量比为16:15 | |
| B. | 标准状况下1molCO和CO2的混合物的体积约占22.4L | |
| C. | 24gMg在足量空气中完全燃烧失去2NA个电子 | |
| D. | 常温下,18gH2O含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液中加入NaA固体后,$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常温下,0.1mol/LNaA溶液水解常数为10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N键 | O=O键 | = ← N O键 |
| 键能/kJ•moL-1 | 945 | 498 | 630 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应都不需要加热 | |
| B. | 化学反应的热效应数值与参加反应的物质多少有关 | |
| C. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| D. | 焓变是指1 mol物质参加反应时的能量变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com