
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
③HClO2可看成是强酸。
(1)160 g·L-1NaOH溶液的物质的量浓度为__________________,若要计算该溶液溶质的质量分数,还需要的一个条件是____。
(2)在发生器中鼓入空气的作用可能是____(填序号)。
A.将SO2氧化成SO3,增强酸性
B.稀释ClO2以防止爆炸
C.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为____;
吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:_________________。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单的实验方法是___________。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是__________________ (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.PbO(悬浊液)
(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____(填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进行的操作是____(填操作名称)。
【答案】4 mol/L 该溶液的密度 B 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 2H2O2![]() 2H2O+O2↑ 连续测定吸收塔内溶液的pH A、D B、E、D或E、D 重结晶
2H2O+O2↑ 连续测定吸收塔内溶液的pH A、D B、E、D或E、D 重结晶
【解析】
NaClO3溶液与稀硫酸在ClO2发生器中发生反应产生ClO2,ClO2在二氧化硫和空气混合气体中不易分解爆炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO23H2O。
(1)浓度g/L表示1 L溶液中所含溶质质量的多少,160 g/LNaOH溶液表示1 L氢氧化钠溶液含有160 gNaOH,假设溶液体积为1 L,则160 gNaOH的物质的量n(NaOH)= ![]() =4 mol,所以该溶液氢氧化钠的物质的量浓度c(NaOH)=
=4 mol,所以该溶液氢氧化钠的物质的量浓度c(NaOH)=![]() =4 mol/L,若要计算该溶液的质量分数,必须知道溶液的质量,据m(溶液)=ρ·V可知,还要知道溶液的密度;
=4 mol/L,若要计算该溶液的质量分数,必须知道溶液的质量,据m(溶液)=ρ·V可知,还要知道溶液的密度;
(2)由信息②可知,纯ClO2易分解爆炸,发生器中鼓入空气的作用应是稀释ClO2,以防止爆炸,故合理选项是B;
(3)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,H2O2分解的化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(4)NaClO2在溶液pH>11.5时的碱性溶液中比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单的实验方法是连续测定吸收塔内溶液的pH;
(5)吸收塔中还原性要适中,还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2,Na2S、FeCl2还原性较强,生成物与NaClO2分离比较困难,PbO悬浊液与水反应产生Pb2+和水,Pb2+还原性较弱,可以加入,故合理选项是AD;
(6)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,故分离混合物的方法是B、E、D或E、D;
然后再通过过滤得到粗晶体,得到的粗晶体经过重结晶可得到纯度更高的晶体,要得到更纯的NaClO2·3H2O晶体必须进行的操作是重结晶。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到固体TiO2。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为___________________________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是__________________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_______________________;
使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号)。

(4)滴定终点的现象是_____________________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为__________________________________________。
(6)若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B。则符合上述条件的烃A有几种(考虑顺反异构)
已知: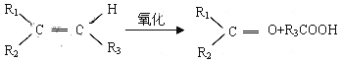
A. 3 B. 4 C. 6 D. 8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
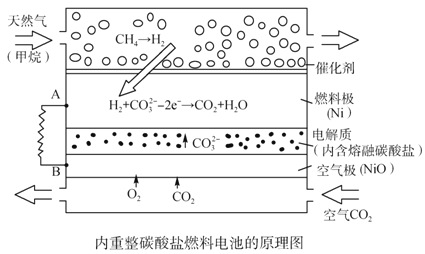
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置

(1)要将C装置接入B和D之间,正确的接法是:a→________→________→ d 。
(2)实验开始先点燃A处的酒精灯,打开活塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为__________________________________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是_________________________________________________________________。
(3) D处反应完毕后,关闭弹簧夹K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是_________________________________________________________,B的作用是______________________________________________________。
(4)A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图。
__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如图实验装置探究硝酸的性质,根据图示判断下列结论不正确的是

A. 试管内壁上的“黄霜”的成分是硫
B. 该实验既说明了浓硝酸具有氧化性,又说明了浓硝酸具有挥发性
C. 烧杯内氢氧化钠溶液的作用是除去尾气,防止尾气污染环境
D. 试管中浓硝酸可以用浓盐酸代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,某固体氧化物为电解质的新型燃料电池。该电池的工作温度可高达700~900℃,生成物均为无毒无害的物质。下列说法错误的是
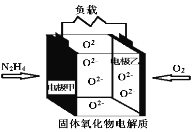
A.电池总反应为:N2H4+2O2=2NO+2H2O
B.电池内的O2由电极乙移向电极甲
C.当甲电极上消耗lmol N2H4时,乙电极理论上有 22.4L(标准状况下)O2参与反应
D.电池正极反应式为:O2+4e=2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com