
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:2 NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)实验室制备NH3的化学方程式是: 。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
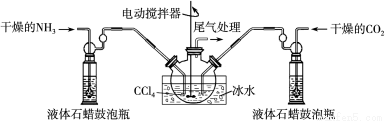
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是 。液体石蜡鼓泡瓶的作用是 。
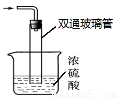 ②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是 (填写选项序号)。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是 (填写选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 真空40 ℃以下烘干
③尾气处理装置如右图所示。双通玻璃管的作用: ;
浓硫酸的作用: 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7825 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为 。
(1)2NH4Cl + Ca(OH)2 △2NH3 ↑+ CaCl2 + 2H2O(未写条件扣1分)(2分)
(2)① 降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解)(2分);通过观察气泡,调节NH3与CO2通入比例(2分)② 过滤(1分) c(1分)
③防止倒吸(2分)吸收多余氨气,防止空气中水蒸气进入反应器使氨基甲酸铵水解(2分)
(3)75%(3/4、0.75,其它结果不给分)(3分)
【解析】
试题分析:(1)实验室制备NH3的化学方程式是2NH4Cl + Ca(OH)2  2NH3 ↑+ CaCl2 + 2H2O。
2NH3 ↑+ CaCl2 + 2H2O。
(2)①因为反应放热,降低温度,提高反应物转化率,同时,防止因反应放热造成产物分解;通过观察气泡,调节NH3与CO2通入比例②反应后的固体和液体的混合物,分离出产品的实验方法是过滤。因为氨基甲酸铵热稳定性差,为了得到干燥产品,应采取的方法是真空40 ℃以下烘干;③图中尾气处理装置使用了截面积较大的玻璃管,可防止倒吸;浓硫酸可以吸收多余氨气,防止空气中水蒸气进入反应器使氨基甲酸铵水解。
(3)由NH2COONH4——CaCO3可知0.7825 g NH2COONH4是0.0133mol,1.000 g CaCO3是0.01mol,样品中氨基甲酸铵的物质的量分数为75%。
考点:化学实验设计和产品纯度计算。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源:2013-2014湖南省益阳市高二上学期期末考试化学试卷(解析版) 题型:实验题
实验室利用如图中装置制取乙酸异戊酯,其合成过程为:
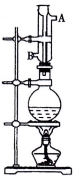
①向圆底烧瓶中加入几粒碎瓷片,并注入0.14 mol异戊醇和0.35mol冰醋酸,再加入4mL浓H2SO4至不再分层。②在烧瓶上安装冷凝回流装置,加热混合物1h后,冷却至室温。③把混合物转至分液漏斗中,加入少量蒸馏水,振荡分层后除去水层,再用蒸馏水洗涤有机层。④用5%的NaHCO3溶液分几次洗涤产品直至中性。⑤向上述溶液中加NaCl晶体,搅拌静置,对液体进行分液。⑥将粗产品转至蒸馏烧瓶中,加入碎瓷片,并加适量无水MgSO4或Mg(NO3)2,蒸馏,收集135-143℃之间的馏分。
试回答下列问题:
(1)冷凝管中冷却水的流向是由 进入,由 (均填“A”或“B”)流出。
(2)圆底烧瓶中的物质 (填“会”或“不会”)从冷凝管上口跑掉,是因为 。
(3)合成实验中浓H2SO4的作用是 。
碎瓷片的作用是 。
(4)乙酸与异戊醇的物质的量之比0.35:0.14>1:1的原因是 。
(5)在③中用蒸馏水多次洗涤的作用是 。
④中用NaHCO3溶液洗涤产品的作用是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(15分)【化学——选修2:化学与技术】
(一)硫酸厂常用煅烧黄铁矿(FeS2)来制取硫酸。
(1)煅烧黄铁矿的主要化学方程式为 。
(2)SO2和O2的反应为 2SO2(g)+O2(g) 2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
A.v正(SO2)=v正(SO3)
B.各组分的体积分数不再变化
C.反应体系的温度不再变化
D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
(3)热交换器是实现冷热交换的装置,化学实验中也经常利用热交换来实现某种实验目的。试分析气、液热交换时通常使用的仪器是________________________。(写名称)
(4)硫酸工业所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是___________________。(填序号)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀硫酸
C. 氨水、酚酞试液 D.碘水、淀粉溶液
(二)实验室常用硫酸厂的烧渣(主要成分是Fe2O3及少量FeS、SiO2)来制备绿矾(FeSO4·7H2O)。
其中测定绿矾产品中FeSO4·7H2O含量的实验步骤为:
a.称取5.2 g产品,溶解,配成250 mL溶液
b.量取25.00 ml待测液于锥形瓶中
c.用硫酸酸化的0. 01 mol/LKMnO4 溶液滴定至终点,消耗KMnO4溶液体积35.00 mL。
据此,请分析:
(1)滴定时反应的离子方程式为(完成并配平离子反应方程式)。

(2)滴定达到终点的标志是 。
(3)产品中FeSO4·7H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
25℃ 时,水的离子积为Kw ,该温度下将 a mol ·L-1一元酸 HA 与b mol·L-1一元强碱BOH 等体积混合,若恰好完全反应,下列结论中不正确的是
A. 混合液中:c(H+ ) ≤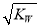 B. 混合液中:c(HA)+c(A-)=a mol·L-1
B. 混合液中:c(HA)+c(A-)=a mol·L-1
C. a = b D. 混合液中:c(H+)+c(B+)= c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省岳阳市高三教学质量检测二理综化学试卷(解析版) 题型:填空题
前不久媒体报道某品牌白酒塑化剂超标2.6倍,塑化剂并非食品或食品添加剂,且对人体有害。一种塑化剂DIBP仅含C、H、O三种元素,相对分子质量小于280,氧的百分含量为23.02%, DIBP分子中苯环上二位取代,且分子中含2个酯基。
(1)DIBP的分子式为 。
(2)塑化剂DEHP是DIBP的同系物,存在如图所示的转化关系。
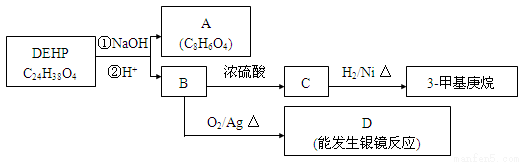
①A是苯环的邻二位取代,则A的结构简式是 。
A与乙二醇发生缩聚反应的化学方程式为 。
②D分子所含官能团的名称是 。
③B分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是 。
(3)F是A的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
b.遇FeCl3溶液显示特征颜色;
c.能与NaHCO3溶液反应。
写出F与足量NaHCO3溶液反应的化学方程式 。
(4)有机物M与DIBP也互为同系物,分子式为C10H10O4, M核磁共振氢谱出现三组峰,则有机物M的结构共有 种。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省岳阳市高三教学质量检测二理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,8gO2含有4NA个电子
B.1L 1mol/L 的NaClO 溶液中含有ClO-的数目为NA
C.标准状况下,22.4L盐酸含有NA个HCl分子
D.1mol Na被完全氧化生成Na2O2,失去2NA个电子
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:填空题
(10分) 按下列要求回答:现有: ①BaCl2;②冰;③NH4Cl;④Na2SO4;⑤干冰;⑥碘片 六种物质。
(1) 属于离子化合物的是__________(填序号,下同),物质中只有离子键的物质有________,
属于共价化合物的是________。
(2) 熔化时不需要破坏化学键的是__________,熔点最低的是__________。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
下列A、B两种元素的原子序数,其中可以组成AB2型离子化合物的是
A.6和8 B.19和16 C.12和17 D.10和8
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:选择题
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
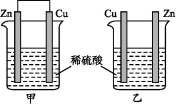
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱 D.产生气泡的速率甲比乙慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com