
����11�֣���ҵ��ˮ�г�����һ������Cr2O72-��CrO42-�����ǻ�����༰��̬ϵͳ�����ܴ���˺���������д��������õĴ������������֡�
����l����ԭ������
�÷��Ĺ�������Ϊ��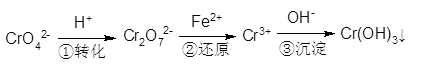
���еڢٲ�����ƽ�⣺2CrO42-(��ɫ)+2H+ Cr2O72-(��ɫ)+H2O
Cr2O72-(��ɫ)+H2O
(1)��ƽ����ϵ��pH��2������Һ�� ɫ��
(2)��˵���ڢٲ���Ӧ��ƽ��״̬���� ��
A��Cr2O2- 7��CrO2- 7��Ũ����ͬ B��2v(Cr2O2- 7)��v(CrO2- 4) C����Һ����ɫ����
(3)�ڢ۲����ɵ�Cr(OH)3����Һ�д������³����ܽ�ƽ�⣺ Cr(OH)3(s)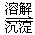 Cr3+(aq)+3OH��(aq)
Cr3+(aq)+3OH��(aq)
�����£�Cr(OH)3���ܶȻ�Ksp��c(Cr3+)?c3(OH-)��10-32,Ҫʹc(Cr3+)����10-5mol��L����Һ��pHӦ���� ��
����2����ⷨ
�÷���Fe���缫��⺬Cr2O72-�����Է�ˮ�����ŵ����У�������������ҺpH���ߣ�����Cr(OH)3������
(4)��Fe���缫��ԭ��Ϊ ��
(5)������������ҺpH���ߵ�ԭ����(�õ缫��Ӧʽ����) ����Һ��ͬʱ���ɵij������� ��
����11�֣���1���� ��1�֣�����2��C��2�֣��� ��3��5��2�֣���
��4��������ӦΪFe��2e����Fe2+��2�֣����ṩ��ԭ��Fe2+��1�֣�
��5��2H+ +2e����H2��(2��)��Fe(OH)3 (1��)
���������������1��pH=2˵����Һ�����ԣ�ƽ��������Ӧ�����ƶ���Cr2O72����Ũ�Ȼ�����������Һ�Գ�ɫ��
��2����һ�������µĿ��淴Ӧ�������Ӧ���ʺ��淴Ӧ������ȣ���Ӧ���Ũ�����������Ũ�Ȳ��ٸı�ʱ���ÿ��淴Ӧ�͵��ﻯѧƽ��״̬��ƽ��ʱŨ�Ȳ��ٷ����仯��������֮���Ũ�Ȳ�һ����Ȼ�����ij�ֹ�ϵ�����ѡ��A����ȷ�����κ������Cr2O72����CrO42���ķ�Ӧ����֮����������1:2�����ѡ��BҲ����ȷ����ɫ����dz��Ũ���й�ϵ����Һ��ɫ���ٸı䣬��˵��Cr2O72����CrO42����Ũ�Ȳ��ٷ����ı䣬��˿���˵����Ӧ�Ѿ��ﵽ��ѧƽ��״̬��C��ȷ����ѡC��
��3�����ܶȻ������ı���ʽKsp��c(Cr3+)��c3(OH��)��10-32��֪����c(Cr3+)��10-5mol/Lʱ��c(OH��)��10-9mol/L������pH��5��
��4��Cr2O72��Ҫ����Cr(OH)3�����������л�ԭ�����������缫ʱ���������Ͽ���ʧȥ���Ӳ���Fe2+����������ʽΪFe��2e����Fe2+��
��5���ڵ������������������õ����ӣ�����Һ������H+�õ��ӵ�����ǿ��Fe2+�ģ����������H+�ŵ磬����ʽΪ2H++2e����H2�������ŵ��Ľ��У���Һ�е�H+Ũ�����ͣ�ˮ�ĵ��뱻�ٽ���OH��Ũ�������ߡ�����Fe2+��Cr2O72����������Fe3+������Һ���Դﵽһ���̶�ʱ�ͻ����Fe(OH)3������
���㣺�������������ƽ��״̬��Ӱ�졢ƽ��״̬���жϣ��ܽ�ƽ�⡢�绯ѧԭ����Ӧ�úͼ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�õ�����(Si3N4)�մɴ���������췢���������Ȳ���, �ܴ������߷���������Ч�ʡ���ҵ���û�ѧ����������Ʊ�������, �䷴Ӧ����: 3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ��H <0
Si3N4(s)+12HCl(g) ��H <0
����������:
��1����һ���¶��½���������Ӧ, ����Ӧ�������ݻ�Ϊ2 L, 3 min��ﵽƽ��, ��ù�������������2. 80 g, ��ת�Ƶ��ӵ����ʵ���Ϊ ��H2��ƽ����Ӧ����Ϊ��������mol/(L·min); �÷�Ӧ��ƽ�ⳣ������ʽK=������������������
��2��������Ӧ�ﵽƽ���, ����˵����ȷ��������������
a. ������������, ѹǿ����, ƽ�ⳣ��K��С
b. ������������, �¶�����, ƽ�ⳣ��K��С
c. ������������, ����Si3N4���ʵ���,ƽ�������ƶ�
d. ������������, ����HCl���ʵ���,ƽ�������ƶ�
��3��һ��������, ���ܱպ��ݵ�������, �ܱ�ʾ������Ӧ�ﵽ��ѧƽ��״̬��������������
| A��3v��(N2)=v��(H2) | B��v��(HCl)=4v��(SiCl4) |
| C����������ܶȱ��ֲ��� | D��c(N2)��c(H2)��c(HCl)=1��3��6 |
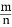 , ����������������, �����¶Ⱥ�ﵽ�µ�ƽ��ʱ, H2��HCl�����ʵ���֮��������
, ����������������, �����¶Ⱥ�ﵽ�µ�ƽ��ʱ, H2��HCl�����ʵ���֮��������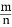 (�>������=����<��)��
(�>������=����<��)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
300��ʱ����2mol A��2mol B������������2L�ܱ������У��������·�Ӧ��3A(g)+B(g) 2C(g)+2D(g) ��H��2minĩ�ﵽƽ�⣬����0.8mol D��
2C(g)+2D(g) ��H��2minĩ�ﵽƽ�⣬����0.8mol D��
(1)��2minĩʱ��A��ƽ��Ũ��Ϊ_____________��B��ת����___________��0-2min��D��ƽ����Ӧ����Ϊ_____________��
(2)�÷�Ӧ��ƽ�ⳣ������ʽΪ��K=_____________�����¶��µĻ�ѧƽ�ⳣ����ֵΪ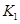 =____________��
=____________��
��֪350��ʱ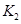 =l�����H________0���>����<������
=l�����H________0���>����<������
(3)��300��ʱ�����÷�Ӧ����ѹ�����ΪlL����A��ת����___________�����������С�����䡱����ԭ����__________________���������µ�ƽ�ⳣ��Ϊ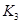 �� ��K3________
�� ��K3________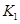 �����<����>����=������ԭ����_______________________��
�����<����>����=������ԭ����_______________________��
(4)���жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������__________________����ѡ�۷֣���
A��������ѹǿ���� B�����������c(A)����
C�� (A)=
(A)=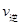 (C) D����������ܶȲ���
(C) D����������ܶȲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����仯������������������Ӧ�ù㷺��
��1��һ�������£�Fe��CO2�ɷ�����Ӧ��
2Fe(s)+3CO2(g) Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
�÷�Ӧ��ƽ�ⳣ��(K ) ���¶�(T ) ���߶�����
�ٸ÷�Ӧ��ƽ�ⳣ��K=______���������ʽ��
�����д�ʩ�У���ʹƽ��ʱc(CO)��c(CO2) ������� (����)��
| A�������¶� | B������ѹǿ |
| C������һ����CO | D���ټ�һЩ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(12��)�����Ϊ2L�Ĺ̶��ܱ�������ͨ��3molX����,��һ���¶��·������·�Ӧ��
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
��1����5min��Ӧ�ﵽƽ��,��ʱ��������ڵ�ѹǿΪ��ʼʱ��1.2��,����Y�����ʵ���Ũ�ȱ仯��ʾ������Ϊ ��
��2����������Ӧ�ڼס��ҡ��������ĸ�ͬ�����ܱ������н���,��ͬһ��ʱ���ڲ�������ڵķ�Ӧ���ʷֱ�Ϊ����v(X)��3.5mol/(L?min)����v(Y)��2mol/(L?min)����v(Z)=4.5mol/(L?min)����v(X)��0.075mol/(L?s)��������������ͬ,�¶Ȳ�ͬ�����¶��ɸߵ��͵�˳����(�����) ��
��3������ﵽ(1)��ƽ����ϵ�г������,��ƽ���� (��"��"��"��"��"��")�ƶ�������
�ﵽ(1)��ƽ����ϵ�����߲��ֻ������,��ƽ���� (��" �� " �� " �� " �� " ��")�ƶ���
��4��������ͬ��������ﵽ(1)������ƽ����ϵ���ٳ���0.5molX����,��ƽ���X��ת���ʢ���ŵ�
ƽ���е�X��ת������Ƚ� ��
| A����ȷ�� | B����һ�����ڢ� | C����һ�����ڢ� | D����һ��С�ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״�����Ҫ�Ļ���ԭ�Ϻ����Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2�������״����״���
���������Ϣ���±���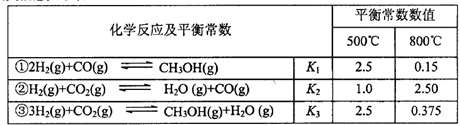
��1����Ӧ����____��Ӧ��ѡ����ȡ������ȡ�����
��2�����ϱ���Ϣ�Ƶ���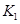 ��
��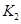 ��
��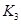 ֮��Ĺ�ϵ��
֮��Ĺ�ϵ��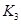 =______��
=______��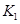 ��
��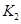 ��ʾ����500��ʱ��÷�Ӧ����ijʱ�̣�
��ʾ����500��ʱ��÷�Ӧ����ijʱ�̣�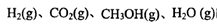 ��Ũ��(mol/L)�ֱ�Ϊ0 8��0.1��0 3��0 15����ʱ
��Ũ��(mol/L)�ֱ�Ϊ0 8��0.1��0 3��0 15����ʱ ��ѡ�>����<����=������
��ѡ�>����<����=������
��3)��ij�¶��·�Ӧ�ٴӿ�ʼ��ƽ��CO��CH3OH��Ũ�ȱ仯��ͼһ��ʾ������H2Ũ�ȱ仯��ʾ�˶�ʱ���ڸ÷�Ӧ��ƽ����.v(H2)= ��ij�¶��·�Ӧ����H2��ƽ��ת����(a)����ϵ��ѹǿ(P)�Ĺ�ϵ��ͼ����ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ�� ��ѡ�>����<����=������
��ѡ�>����<����=������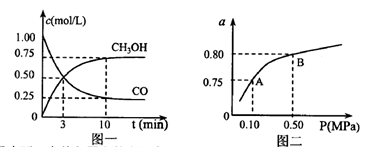
��4��һ���¶��£�������̶����ܱ������з�����Ӧ�ڣ����жϸ÷�Ӧ�Ѿ��ﵽƽ�����____��������Ӧ��ĸ��ʾ��
| A����������ѹǿ���� |
| B����̨�����ƽ��Ħ������Ҳʼ�ձ��ֲ��䣬 |
| C�����������ܶȲ��� |
| D��CO2(g)��CO(g)��Ũ�Ȳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2(g)��3H2(g) 2NH3(g) ��H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
2NH3(g) ��H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺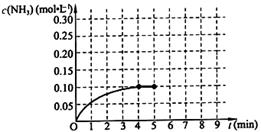
����ͼ������ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v(NH3)= ��
��������������˵��������Ӧ�Ѵ�ƽ����� ��
| A��3v����H2����2v����NH3�� |
| B�������������ƽ����Է���������ʱ����仯 |
| C��������������ܶȲ���ʱ����仯 |
| D������������ķ�����������ʱ����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о�NO2��SO2��CO�ȴ�����Ⱦ��Ĵ���������Ҫ���塣NO2�������з�Ӧ��������
6 NO2(g)+8NH3(g)  7N2(g)+12H2O(g)+Q��Q��0����
7N2(g)+12H2O(g)+Q��Q��0����
���������գ�
��1����Ӧ��ƽ�ⳣ������NO2��Ч�ʸߡ�����÷�Ӧƽ�ⳣ���Ĵ�ʩ�� ��
��2��һ��������������Ӧ��ij����̶����ܱ������н��У���˵���÷�Ӧ�Ѿ��ﵽƽ��״̬���� ��
a��c(NO2)��c(NH3) = 3��4 b��6v(NO2) = 7v(N2)
c��������������ѹǿ���ٱ仯 d�������������ܶȲ��ٱ仯
��3����ƽ��ʱNO2��N2��Ũ��֮��Ϊm/n�����������������䣬��С��Ӧ�����������ﵽ�µ�ƽ�⣬��ʱNO2��N2��Ũ��֮�� m/n���>������=����<������
��4��ij�¶��£���һ���ݻ�Ϊ2���ķ�Ӧ�����ڣ�������Ӧ2���Ӻ�ﵽƽ�⣬��øպ���3mol���ӷ���ת�ƣ�����2������NH3��ƽ����Ӧ����Ϊ��
v(NH3) = ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪2A��g����B��g�� 2C��g�������ݻ�Ϊ1L���ܱ������м���0.050 mol A��0.025mol B����500��ʱ��ַ�Ӧ����ƽ�����c��C��="0.040" mol��L-1���ų�����Q1kJ��
2C��g�������ݻ�Ϊ1L���ܱ������м���0.050 mol A��0.025mol B����500��ʱ��ַ�Ӧ����ƽ�����c��C��="0.040" mol��L-1���ų�����Q1kJ��
����˵��������Ӧ�Ѿ��ﵽ��ѧƽ��״̬���� ����д��ţ�
a.v(C)=2v(B) b.������ѹǿ���ֲ���
c.v��(A)=2v��(B) d.������������ܶȱ��ֲ���
��������ͬ��������ֻ����0.050 mol C��500��ʱ��ַ�Ӧ��ƽ�����������Q2kJ����Q1��Q2֮��Ĺ�ϵʽ�ɱ�ʾΪ ���ú�Q1��Q2�Ĵ���ʽ��ʾ����
��500��ʱ��������Ӧ�Ļ�ѧƽ�ⳣ��K= ��
����֪��K��300�棩��K��350�棩���÷�Ӧ�� ����š����������ȷ�Ӧ������Ӧ�¶����ߣ�A��ת���� �����������С�����䡱����
��ij�¶��£�A��ƽ��ת���ʣ�a������ϵ��ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��ƽ��״̬��a�䵽bʱ����ѧƽ�ⳣ��K��A�� K��B�������������������=������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com