
分析 (1)碘是合成甲状腺激素的主要元素;
(2)根据碘的生理功能,以及甲状腺机能亢进、佝偻病、地方性甲状腺肿的成因判断;
(3)根据氧化还原反应中氧化剂和还原剂的概念以及碘单质遇淀粉试液变蓝色来回答.
解答 解:(1)人体摄入的碘主要是来自海产品和碘盐,碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大和呆小症,故选B;
(2)A.甲状腺机能亢进是因碘摄入太多造成的,故A错误;
B.钙主要存在于骨胳和牙齿中,使骨和牙齿具有坚硬的结构支架,缺乏幼儿和青少年会患佝偻病,老年人会患骨质疏松,碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大和呆小症,故B错误;
C.碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大,故C正确;
D.雄性激素减少与碘缺乏无关,故D错误.
故选C;
(3)碘化钾和碘酸钾在酸性条件下能发生氧化还原反应生成碘5KI+KIO3+6HCl=6KCl+3H2O+3I2;该反应中KI是还原剂,KIO3是氧化剂,碘遇淀粉试液变蓝色,所以反应现象为:溶液由无色变蓝色,故答案为:KIO3;溶液变蓝色.
点评 本题考查了碘及其化合物的性质应以及氧化还原反应的概念知识,特别要注意氧化还原反应中氧化产物和还原产物是同一物质的化学反应,难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A、B中的氢的质量分数必相等 | |
| B. | A、B的实验式必相同 | |
| C. | A、B一定是同系物 | |
| D. | A、B可以是烃,也可以是烃的含氧衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Fe3+、Br-、NO3- | B. | Fe2+、H+、NO3-、K+ | ||
| C. | Fe3+、Br-、NO3-、Cl- | D. | Fe2+、Br-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③①②④ | C. | ④③②① | D. | ③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
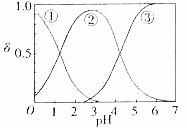 草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.
草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 30min时降低温度,40min时升高温度 | |
| B. | 前8min A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为吸热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com