
分析 提纯粗盐时,先把粗盐溶解,再通过过滤除去泥沙等不溶于水的物质,再通过蒸发结晶可以得到精盐,固体溶解度随着温度变化不大的物质需蒸发结晶,氯化钠属于该类,据此分析所需实验仪器.
解答 解:粗盐提纯是通过溶解把不溶物与食盐初步分离,粗盐提纯的主要步骤:溶解,将粗盐逐渐加入盛有水的烧杯里,边加边用玻璃棒搅拌,直加到粗盐不再溶解时为止;过滤食盐水,如滤液浑浊,应再过滤一次,过滤需铁架台(含铁圈)、烧杯(盛放浊液、承接滤液)、玻璃棒引流;蒸发结晶,固体溶解度随着温度变化不大的物质需蒸发结晶,氯化钠属于该类,所以把所得滤液倒入蒸发皿,用酒精灯加热,待蒸发皿中出现较多固体时,停止加热,利用余热蒸干,所以实验过程中需要用到的玻璃仪器有玻璃棒还有烧杯、酒精灯、漏斗.
故答案为:溶解;过滤;蒸发结晶;烧杯、酒精灯、漏斗.
点评 本题考查粗盐的提纯,掌握粗盐提纯的原理、步骤等是正确解答本题的关键,题目难度不大,


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:实验题
 实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:
实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
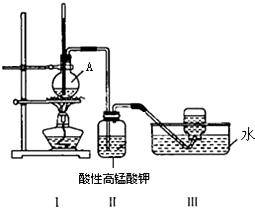 某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:
某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
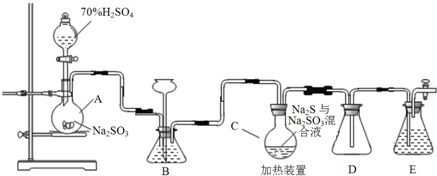
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡正向移动 | C. | A的转化率降低 | D. | C的物质的量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com