


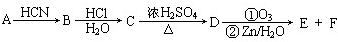
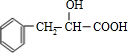
| 浓硫酸 |
| △ |
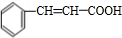 +H2O
+H2O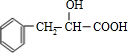
| 浓硫酸 |
| △ |
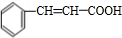 +H2O
+H2O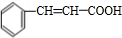
| 一定条件 |
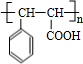
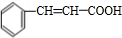
| 一定条件 |



| 35.2g |
| 44g/mol |
| 7.2g |
| 18g/mol |
| 1.6g |
| 16g/mol |
| 0.8mol |
| 0.1mol |
| 0.4mol×2 |
| 0.1mol |
| 0.1mol |
| 0.1mol |
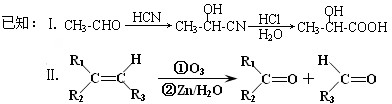
 ,由信息Ⅰ可知,
,由信息Ⅰ可知, 与HCN发生加成反应生成B,故B为
与HCN发生加成反应生成B,故B为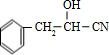 ,B水解生成C,故C为
,B水解生成C,故C为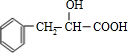 ,C在浓硫酸、加热条件下生成D,D能使溴的四氯化碳溶液褪色,故为发生消去反应,故D为
,C在浓硫酸、加热条件下生成D,D能使溴的四氯化碳溶液褪色,故为发生消去反应,故D为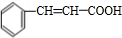 ,
,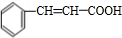 氧化生成E与F,由信息Ⅱ可知氧化为
氧化生成E与F,由信息Ⅱ可知氧化为 、OHC-COOH,F继续被氧化生成G,G的相对分子质量为90,故F为OHC-COOH,E为
、OHC-COOH,F继续被氧化生成G,G的相对分子质量为90,故F为OHC-COOH,E为 ,G为HOOC-COOH,据此解答.
,G为HOOC-COOH,据此解答.| 35.2g |
| 44g/mol |
| 7.2g |
| 18g/mol |
| 1.6g |
| 16g/mol |
| 0.8mol |
| 0.1mol |
| 0.4mol×2 |
| 0.1mol |
| 0.1mol |
| 0.1mol |
 ,由信息Ⅰ可知,
,由信息Ⅰ可知, 与HCN发生加成反应生成B,故B为
与HCN发生加成反应生成B,故B为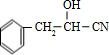 ,B水解生成C,故C为
,B水解生成C,故C为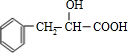 ,C在浓硫酸、加热条件下生成D,D能使溴的四氯化碳溶液褪色,故为发生消去反应,故D为
,C在浓硫酸、加热条件下生成D,D能使溴的四氯化碳溶液褪色,故为发生消去反应,故D为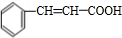 ,
,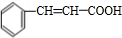 氧化生成E与F,由信息Ⅱ可知氧化为
氧化生成E与F,由信息Ⅱ可知氧化为 、OHC-COOH,F继续被氧化生成G,G的相对分子质量为90,故F为OHC-COOH,E为
、OHC-COOH,F继续被氧化生成G,G的相对分子质量为90,故F为OHC-COOH,E为 ,G为HOOC-COOH,
,G为HOOC-COOH, ,故答案为:
,故答案为: ;
;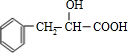 ,含有苯环,可以与氢气发生加成反应,含有羟基,可以与甲酸发生酯化反应,不能在碱性溶液中发生水解反应,不能与Ag(NH3)2OH溶液发生银镜反应,故答案为:①③;
,含有苯环,可以与氢气发生加成反应,含有羟基,可以与甲酸发生酯化反应,不能在碱性溶液中发生水解反应,不能与Ag(NH3)2OH溶液发生银镜反应,故答案为:①③;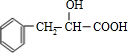 在浓硫酸、加热条件下发生消去反应生成
在浓硫酸、加热条件下发生消去反应生成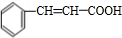 ,反应方程式为:
,反应方程式为: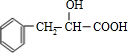
| 浓硫酸 |
| △ |
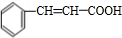 +H2O,
+H2O,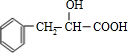
| 浓硫酸 |
| △ |
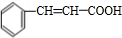 +H2O;消去;
+H2O;消去;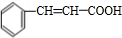 生成高分子化合物的反应为
生成高分子化合物的反应为 ,反应方程式为n
,反应方程式为n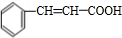
| 一定条件 |
 ,属于加聚反应,
,属于加聚反应,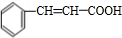
| 一定条件 |
 ;加聚;
;加聚;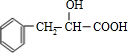 的同分异构体有多种,其中符合下列要求①与C具有相同的官能团种类,含有-OH、-COOH,②遇三氯化铁溶液不显色,不含酚羟基,③苯环上的一氯代物只有两种,苯环上为对位二元取代,符合同分异构体有:
的同分异构体有多种,其中符合下列要求①与C具有相同的官能团种类,含有-OH、-COOH,②遇三氯化铁溶液不显色,不含酚羟基,③苯环上的一氯代物只有两种,苯环上为对位二元取代,符合同分异构体有: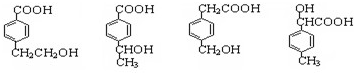 ,
, .
.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
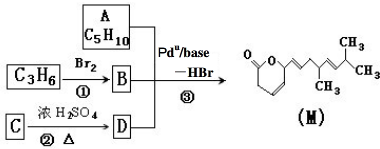
 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省泗县双语中学高一下学期期末考试化学试卷(带解析) 题型:计算题
燃烧法是测定有机化合物分子式的一种重要方法。已知0.1mol某烃A完全燃烧后,生成11.2 L(标准状况)的CO2,生成10.8 g水,回答下列问题。
(1)通过计算推导A的分子式。
(2)写出A可能的结构简式。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高一下学期期末考试化学试卷(解析版) 题型:计算题
燃烧法是测定有机化合物分子式的一种重要方法。已知0.1mol某烃A完全燃烧后,生成11.2 L(标准状况)的CO2,生成10.8 g水,回答下列问题。
(1)通过计算推导A的分子式。
(2)写出A可能的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 、 、 为天然有机高分子化合物。
(2)三大合成材料 、 、 。
(3)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为____________________;2 min末时Y的浓度为________________;化学方程式中n的值是________。
(4)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。其热化学方程式为____________________。
(5)已知拆开1mol H—H键、1mol N—H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com