
���� ��1������CH4��g��+CO2��g��?2CO��g��+2H2��g����H1=+247.3kJ•mol-1
����CO��g��+2H2��g��?CH3OH��g����H2=-90.1kJ•mol-1
����2CO��g��+O2��g��?2CO2��g����H3=-566.0kJ•mol-1
�ɣ���2+����2+������д�Ȼ�ѧ����ʽ��
��2������ƽ����ϵ�и���ֵ����������Ϊ$\frac{1}{4}$����������ʽ�����ƽ��ʱ����ֵĺ���������ƽ�ⳣ����
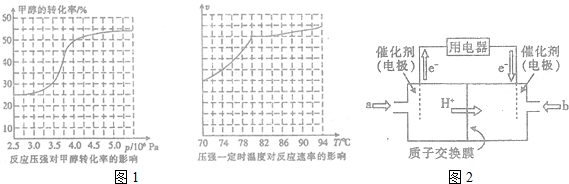
��3��������ת�������߷����жϣ�
��ͼ������������¶ȱ仯�����Ʒ����ش�
��4���ٸ���ͼ֪������Ĥ�����ӽ���Ĥ����������Һ�����ԣ������������ƶ�����֪��ͨ��a�ĵ缫Ϊ������ͨ��b�ĵ缫Ϊ�����������ϼ״�ʧȥ���ӷ���������Ӧ��
�ڸ��ݵ��صĹ���ԭ���͵缫����ʽ�����㣮
��� �⣺��1�����ݣ���CH4��g��+CO2��g��?2CO��g��+2H2��g����H1=+247.3kJ•mol-1
����CO��g��+2H2��g��?CH3OH��g����H2=-90.1kJ•mol-1
����2CO��g��+O2��g��?2CO2��g����H3=-566.0kJ•mol-1
�ɣ���2+����2+����2CH4��g��+O2��g��?2CH3OH��g����H���ʡ�H=2��H1+2��H2+��H3=��+247.3kJ•mol-1����2+��-90.1kJ•mol-1����2+��-566.0kJ•mol-1��=-251.6kJ•mol-1��������CH4��O2ֱ���Ʊ��״��������Ȼ�ѧ����ʽΪ2CH4��g��+O2��g��?2CH3OH��g����H=-251.6kJ•mol-1��
�ʴ�Ϊ��2CH4��g��+O2��g��?2CH3OH��g����H=-251.6kJ•mol-1��
��2��CH4��g��+CO2��g��?2CO��g��+2H2��g��
��ʼ��mol�� 6 6 0 0
�仯��mol�� x x 2x 2x
ƽ�⣨mol��6-x 6-x 2x 2x
ƽ����ϵ�и���ֵ����������Ϊ$\frac{1}{4}$������6-x=2x�����x=2��
����¶��¸÷�Ӧ��ƽ�ⳣ��X=$\frac{c{\;}^{2}��CO��•c{\;}^{2}��H{\;}_{2}��}{c��CH{\;}_{4}��•c��CO{\;}_{2}��}$=$\frac{1{\;}^{2}��1{\;}^{2}}{1��1}$=1��
�ʴ�Ϊ��1��
��3���ٴӷ�Ӧѹǿ�Լ״�ת���ʵ�Ӱ�조Ч�ʡ�����ͼ����ת���ʱ仯������4.0��106Pa���ʴ�Ϊ��4.0��106Pa��
������ͼ������¶��ڸ���80��C�Է�Ӧ����Ӱ�첻��Ӧ�Ƿ��ȷ�Ӧ���¶ȹ��ߣ�ƽ��������У�������ת��������
�ʴ�Ϊ������80��ʱ���¶ȶԷ�Ӧ����Ӱ���С���ҷ�Ӧ���ȣ������¶�ʱƽ�������ƶ���ת���ʽ��ͣ�
��4���ٸ���ͼ֪������Ĥ�����ӽ���Ĥ����������Һ�����ԣ������������ƶ�����֪��ͨ��a�ĵ缫Ϊ������ͨ��b�ĵ缫Ϊ�����������ϼ״�ʧȥ���ӷ���������Ӧ��������ӦʽΪ CH3OH-6e-+H2O=CO2+6H+�������������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪO2+4e-+4H+=2H2O��
�ʴ�Ϊ������
���ô˵���Զ��Ե缫��ⱥ��ʳ��ˮ�ĵ缫��ӦΪ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$H2��+Cl2��+2OH-�����������ռ�����״���µ�����1.12L��0.05mol��ʱ���������������Ƶ����ʵ�����0.05mol������COH-=$\frac{0.05mol}{0.5L}$=0.1mol/L������PH=13���ʴ�Ϊ��13��
���� ���⿼���Ϊ�ۺϣ��漰�˸�˹���ɵ�Ӧ�á��Ȼ�ѧ����ʽ�ļ�����д����ѧƽ��ļ��㡢ͼ������ж��Լ��绯ѧ��֪ʶ�ȣ�ע����ո�˹���ɵ����ã�����ԭ��صĹ���ԭ������Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������ | B�� | ������Һ��ǿ����Һ��Ӧ | ||
| C�� | ǿ����Һ��ǿ����Һ��Ӧ | D�� | ��Ԫǿ����Һ��һԪǿ����Һ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢܢ� | B�� | �ۢݢ� | C�� | �٢ڢ� | D�� | �٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�32 g O3���е���ԭ����ĿΪ2NA | |
| B�� | 5.6 g��Fe������Cl2����ȫȼ��ת�Ƶ�����Ϊ0.2NA | |
| C�� | 0.1 mol•L-1 Na2SO4��Һ���е���������ĿΪ0.2NA | |
| D�� | ��״���£�22.4 L�����е�̼ԭ����ĿΪ6NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| ���� | HNO2 | HClO | H2CO3 | H2SO3 |
| ����ƽ�ⳣ�� ��25�棩 | Ki=5.1��10-4 | Ki=2.98��10-8 | $\begin{array}{l}{K_{i1}}=4.3��{10^{-7}}\\{K_{i2}}=5.6��{10^{-11}}\end{array}$ | $\begin{array}{l}{K_{i1}}=1.54��{10^{-2}}\\{K_{i2}}=1.02��{10^{-7}}\end{array}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �� | �� | �� | |
| �ݻ� | 1L | 1L | 0.5L |
| ��ʼ�������� | X��2mol��Y��1mol | Z��2mol | X��0.5mol��Y��0.25mol |
| ƽ��ʱ | c��Z��=1.2mol•L-1 | c��Z��=1.2mol•L-1 |
| A�� | T��ʱ�÷�Ӧ��ƽ�ⳣ��KΪ3.75 | |
| B�� | ƽ��ʱ��Xת���ʣ��ף��� | |
| C�� | �����Ǿ�����������ƽ��ʱ��c��Z����1.2mol•L-1 | |
| D�� | ǰ2min�ڣ�����������X��ʾ��ƽ����Ӧ����v��X��=0.6mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶ȡ� | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com