
 CH4和CO2可以制造价值更高的化学产品.已知:
CH4和CO2可以制造价值更高的化学产品.已知:分析 (1)已知①CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H1=a kJ/mol
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2=b kJ/mol
③2CO(g)+O2(g)?2CO2(g)△H3=c kJ/mol
①+2×②-2×③得:CH4(g)+CO2(g)?CO(g)+2H2(g)△H,依据盖斯定律计算反应热;
(2)据反应物和生成物可知,参与大气循环的无机化合物为二氧化碳,据原子守恒书写化学方程式;
依据二甲醚与乙醇结构判断;
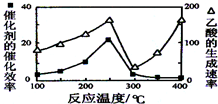
(3)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;
②温度升高,化学反应速率加快.
解答 解:(1)已知①CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H1=a kJ/mol
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2=b kJ/mol
③2CO(g)+O2(g)?2CO2(g)△H3=c kJ/mol
据盖斯定律,①+2×②-2×③得:CH4(g)+CO2(g)?CO(g)+2H2(g)△H=(a+2b-2c)kJ/mol,
故答案为:CH4(g)+CO2(g)?CO(g)+2H2(g)△H=(a+2b-2c)kJ/mol;
(2)据反应物和生成物可知,参与大气循环的无机化合物为二氧化碳,据原子守恒书写化学方程式为:3CO+3H2═CH3OCH3+CO2,
二甲醚结构简式为CH3OCH3,中含有C-H和C-O键,乙醇结构简式为CH3CH2OH,含有C-H,C-O,O-H键,二者完全燃烧生成产物相同都是二氧化碳和水,依据△H=反应物总键能-生成物总键能,可知二者比能量不同;
故答案为:3CO+3H2═CH3OCH3+CO2;不同;
(3)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案为:催化剂的催化效率降低,化学反应速率降低;
②温度升高,化学反应速率加快,故答案为:温度升高,化学反应速率加快.
点评 本题考查了热化学方程式的书写、氧化还原反应方程式书写、影响反应速率的因素,明确盖斯定律计算反应热的方法是解题关键,题目难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一般情况下,σ键比π键重叠程度大,形成的共价键更强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 气体单质分子中,一定有σ键,可能有π键 | |
| D. | 杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
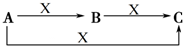 A、B、C、X是中学化学常见的物质,它们之间的转化关系如图所示(反应条件和部分产物省略).请回答下列问题:
A、B、C、X是中学化学常见的物质,它们之间的转化关系如图所示(反应条件和部分产物省略).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙醚从黄花蒿中提取青蒿素 | B. | 由青蒿素( )合成双氢青蒿素( )合成双氢青蒿素( )的反应 )的反应 | ||
| C. | 空气净化器过滤净化空气 | D. | 消毒柜通电产生臭氧的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
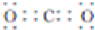 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | 非金属性:Z>W | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 逸項 | 实驗操作及现象 | 实验结论 |
| A | 向某溶洧液中同时滴加几滴KSCN溶液和少量的新制氯水,溶液变成血红色 | 该溶液中一定含有Fe3+ |
| B | 将澄清石灰水滴入可能混有Na2CO3的 NaHCO3溶液中出现白色沉淀 | 该液中一定含有Na2CO3 |
| C | 常温下,用pH计测定某溶液NaHSO3溶液的 pH约为5.20 | 该溶液中HSO3-的电离程度大于它的水解程度 |
| D | 常温下,向某溶液中滴加稀NaOH溶液将湿润的红石蕊试纸置于试管口,试纸不变蓝 | 该溶液中一定不含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3 中所含分子数为NA | |
| B. | 含1mol硅原子的SiO2晶体中Si-O键的个数为4NA | |
| C. | 10L PH=1的硫酸溶液中含有的H+离子数为2NA | |
| D. | 1L 1 mol•L-1 FeCl3溶液完全水解产生的Fe(OH)3胶体粒子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com