
| A. | 肯定有SO2 和NO | B. | 肯定有SO2和NO2 | ||
| C. | 可能有Cl2、NO和O2 | D. | 肯定有SO2、NO和O2 |
分析 Cl2为黄绿色,NO2为红棕色,与无色不符,一定不存在;结合此无色透明的混合气体通过品红溶液后,品红溶液褪色,则一定含SO2;把剩余气体排入空气中,很快变为红棕色,则一定含NO,以此来解答.
解答 解:由无色可知,一定不含Cl2、NO2;
结合此无色透明的混合气体通过品红溶液后,品红溶液褪色,则一定含SO2;把剩余气体排入空气中,很快变为红棕色,则一定含NO,
且NO与O2反应,则一定不存在O2,
综上所述,一定含SO2 和NO,一定不含Cl2、O2、SO2,
故选A.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、SO42-、Cl-、NH4+ | B. | Na+、NO3-、Ag+、CO32- | ||
| C. | Na+、Cl-、NO3-、Cu2+、 | D. | K+、HCO3-、SO42-、OH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
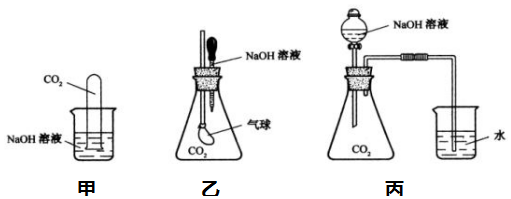
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用干燥的PH试纸可以确定某气体是否是氨气 | |
| B. | 在含有FeCl2杂质的FeCl3溶液中通入足量Cl2后,充分加热,可得到纯净的FeCl3溶液 | |
| C. | 中和热测定实验中,碱液要一次性加入,以防止热量损失 | |
| D. | 为减小中和滴定误差,锥形瓶必须用待测液润洗后才能使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na在空气中长期放置最终变为Na2CO3粉末 | |
| B. | Na2O 和Na2O2都能与水反应生成碱,它们都是碱性氧化物 | |
| C. | 铝与氢氧化钠的反应中水和氢氧化钠均作氧化剂 | |
| D. | 铝箔在空气中受热可以熔化,且发生剧烈燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)CH3OH是一种可燃性的液体.已知3.2gCH3OH充分燃烧生成水蒸气时放热akJ,H2O(g)=H2O(l),△H=-bKJ•mol-1则表示CH3OH的燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+3H2O(l)△H=-(10a+2b)kJ/mol(反应热用含a、b的代数式表示,a、b均大于0)
(1)CH3OH是一种可燃性的液体.已知3.2gCH3OH充分燃烧生成水蒸气时放热akJ,H2O(g)=H2O(l),△H=-bKJ•mol-1则表示CH3OH的燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+3H2O(l)△H=-(10a+2b)kJ/mol(反应热用含a、b的代数式表示,a、b均大于0)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | K+、Mg2+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com