

���� ��ʵ������ģ�ҵ���ȡ��������ƣ��漰SO2��ʵ�����Ʒ���������������Һ����SO2��β�����ص㿼���˲�����ᴿ�����ȵķ���������������ȴ�ᾧ�ķ����ӻ��Һ�л�þ��壬��ͨ��ˮϴ���Ҵ���ϴ������ó�Ʒ��������õζ��ķ����ⶨ���ȣ��漰ԭ���������������ݴ������ݴ˽�����⣻
��1���������ṹ��������֪AΪ������ƿ������Ŀ��Ϣ��֪�����������������ˮ���������Ҵ���Ӧ���Ҵ�ϴ�ӣ��������ܽ����ʧ��
��2��Na2S2O3�����������»ᷴӦ����S�Ͷ�������
��3���������ᣬNa2S2O3��Ӧ����S���������ú�ȡ�ϲ���Һ���μ�BaCl2��Һ��������Һ���Ƿ�����������ӣ�
��4������ͼʾ�ĵζ�����Һ��������������ն�����Ȼ���������ĵ�ı���Һ��������ݷ�Ӧ2S2O32-+I2�TS4O62-+2I-��֪��n��S2O32-��=2n��I2����Ȼ��ⵥ�ʵ����ʵ��������Na2S2O3•5H2O��������Ʒ�Ĵ��ȣ����ζ�ʱ����֣��տ�����Һ�ֲ���ɫ��ֹͣ�ζ���˵����Ӧ��û����ȫ��Ӧ����������μӱ�Һ��������
��5��Na2S2O3��ԭ�Խ�ǿ������Һ���ױ�Cl2������SO42-����Ӧ���������ơ��Ȼ��ƣ���ƽ��д���ӷ���ʽ��
��� �⣺��1���������ṹ��������֪AΪ������ƿ������Ŀ��Ϣ��֪�����������������ˮ���������Ҵ���Ӧ���Ҵ�ϴ�ӣ��������ܽ����ʧ���ʴ�Ϊ��������ƿ���Ҵ���
��2��Na2S2O3�����������»�����S�Ͷ��������ʻ��½����䷴Ӧ�����ӷ���ʽΪ��S2O32-+2H+=S��+H2O+SO2�����ʴ�Ϊ��S2O32-+2H+=S��+H2O+SO2����
��3������Ʒ���Ƿ����Na2SO4��ʵ�鷽��Ϊ��ȡ������Ʒ��������ϡ���ᡢ���á�ȡ�ϲ���Һ������ˣ�ȡ��Һ�����μ�BaCl2��Һ�������ֳ�����˵������Na2SO4���ʣ��ʴ�Ϊ��ȡ������Ʒ��������ϡ���ᡢ���á�ȡ�ϲ���Һ������ˣ�ȡ��Һ�����μ�BaCl2��Һ�������ֳ�����˵������Na2SO4���ʣ�
��4������ͼʾ�ĵζ�����Һ���֪���ζ����г�ʼ����Ϊ2.50mL���ζ��յ�Һ�����Ϊ18.50mL���������ĵ�ı���Һ���Ϊ18.50mL-2.50mL=16.00mL��
���ݷ�Ӧ2S2O32-+I2�TS4O62-+2I-��֪��n��S2O32-��=2n��I2��������1.00 g��Ʒ�к���Na2S2O3•5H2O����Ϊ��0.1000 mol•L-1��16.00��10-3L��2��248g/mol=0.7936g�������Ʒ�Ĵ���Ϊ$\frac{0.7936g}{1.00g}$��100%=79.36%����Ҫ���Ƶμӣ���֪��Һ���ƫС�����²ⶨ���ƫ�ͣ��ʴ�Ϊ��16.00��79.36��ƫ�ͣ�
��5��Na2S2O3��ԭ�Խ�ǿ������Һ���ױ�Cl2������SO42-����ƽ������ӷ���ʽΪ��S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+���ʴ�Ϊ��S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+��
���� ���⿼��ʵ�鷽���������漰����ʶ�𡢶Բ����ķ������ۡ�����ʽ��д�����Ӽ��顢��ѧ����ȣ�����ʵ�����������֪ʶ�ۺ�Ӧ�������Ŀ��飬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ȶ��ԣ�CH4��NH3��H2O��HF | B�� | �۷е㣺CaO��BaO��NaCl��KCl | ||
| C�� | �۷е㣺Na��Mg��Al | D�� | �۷е㣺HF��HCl��HBr��HI |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢ� | B�� | �ڢ� | C�� | �٢� | D�� | �ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2��ת����Ϊ28.57% | B�� | H2��ת����Ϊ85.7% | ||
| C�� | N2���������Ϊ20% | D�� | H2���������Ϊ10% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��2L�����ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯���±���
��2L�����ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯���±���| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ӵ����ģ�ͣ� | |
| B�� | HClO�Ľṹʽ��H-Cl-O | |
| C�� | ������Ϊ53��������Ϊ78�ĵ�ԭ�ӣ�${\;}_{53}^{131}$I | |
| D�� | ����״̬��������صĵ��뷽��ʽ��KHSO4$\frac{\underline{\;����\;}}{\;}$ K++H++SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
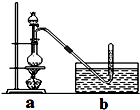 CH3ClΪ��ɫ���Դ���ζ�����壬�ܶ�Ϊ2.25g/L���۵�Ϊ-24.2�棬20��ʱ��ˮ�е��ܽ��Ϊ400mL���������Ҵ��ͱ������л��ܼ���
CH3ClΪ��ɫ���Դ���ζ�����壬�ܶ�Ϊ2.25g/L���۵�Ϊ-24.2�棬20��ʱ��ˮ�е��ܽ��Ϊ400mL���������Ҵ��ͱ������л��ܼ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����ڸ����ʵ�����������ǣ�������
�����ڸ����ʵ�����������ǣ�������| A�� | һ���Ӹ������к���12��Hԭ�� | |
| B�� | �����ʵ�һ�ȴ�����4�� | |
| C�� | ��������ʹ����KMnO4��Һ��ɫ | |
| D�� | 1 mol�����ʷֱ�������H2��NaOH��Һ��Ӧ������H2��NaOH�����ʵ�����Ϊ3mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com