

| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
分析 含钴废料中含有Co2O3、Fe2O3和少量Li、Al,向废料中加入NaOH溶液,只有Al和NaOH反应生成可溶性的NaAlO2,Li和水反应生成微溶的LiOH,然后过滤得到滤渣Co2O3、Fe2O3 和少量LiOH,滤液中含有NaOH和NaAlO2,向滤渣中加入浓盐酸,发生反应Co2O3+6HCl=2CoCl2+Cl2↑+2H2O、Fe2O3+8HCl=2FeCl3+FeCl2+4H2O、LiOH+HCl=LioCl+H2O,得到含有Co的溶液,向溶液中加入碳酸钠溶液和NaF溶液,得到可溶性的CoCO3和Fe(OH)3和LiF沉淀,过滤得到滤渣Fe(OH)3和LiF,滤液中含有CoCO3,向滤液中再加入碳酸钠溶液,得到CoCO3固体,将CoCO3溶液于盐酸和草酸铵的混合溶液,经过滤、洗涤、干燥得到草酸钴晶体,煅烧草酸钴晶体得到CoO,结合题目分析解答;
(1)固体溶液时为增加溶解速率,可通过将固体粉碎、玻璃棒搅拌、加热等措施来实现;
(2)步骤Ⅱ中酸溶时发生了反应Co2O3+6HCl=2CoCl2+Cl2↑+3H2O,可将此反应改写为离子反应方程式;利用此反应可将Co2O3转化为可溶性钴盐溶液,同时有利于沉淀除去Fe3+;
(3)根据Fe3+、Co2+完全沉淀时溶液的pH,可利用来调节溶液pH,除去溶液里的Fe3+,得到Fe(OH)3;
(4)根据LiF难溶于水,添加NaF溶液可除去溶液里的Li+,防止步骤Ⅵ中产生Li2CO3沉淀;
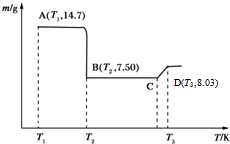
(5)欲得到生成的草酸钴晶体,可通过过滤、洗涤及干燥来达到目的;A为CoC2O4,n(CoC2O4)═0.1mol,m(Co)=0.1mol×59g/mol=5.9g,则B点时,固体中氧元素的物质的量为n(o)═0.1mol,可结合钴和氧原子的物质的量之比确定B点固体物质的化学式,另外C点氧化物的质量为8.03g,则n(O)═1.33mol,以此计算C点固体的化学式,推导出发生反应的化学方程式.
解答 解:含钴废料中含有Co2O3、Fe2O3和少量Li、Al,向废料中加入NaOH溶液,只有Al和NaOH反应生成可溶性的NaAlO2,Li和水反应生成微溶的LiOH,然后过滤得到滤渣Co2O3、Fe2O3 和少量LiOH,滤液中含有NaOH和NaAlO2,向滤渣中加入浓盐酸,发生反应Co2O3+6HCl=2CoCl2+Cl2↑+2H2O、Fe2O3+8HCl=2FeCl3+FeCl2+4H2O、LiOH+HCl=LioCl+H2O,得到含有Co的溶液,向溶液中加入碳酸钠溶液和NaF溶液,得到可溶性的CoCO3和Fe(OH)3和LiF沉淀,过滤得到滤渣Fe(OH)3和LiF,滤液中含有CoCO3,向滤液中再加入碳酸钠溶液,得到CoCO3固体,将CoCO3溶液于盐酸和草酸铵的混合溶液,经过滤、洗涤、干燥得到草酸钴晶体,煅烧草酸钴晶体得到CoO.(1)为提高碱溶速率,除适当增大NaOH溶液浓度、提高反应温度外,还可采取的措施有将废料研磨成更小颗粒,故答案为:将废料研磨成更小颗粒;
(2)步骤Ⅱ中酸溶时发生的离子反应为Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;发生此反应的目的是溶解Co2O3,将三价钴转化为Co2+,便于沉淀除去Fe3+,故答案为:Co2+、Cl2;溶解Co2O3,将三价钴转化为Co2+,便于沉淀除去Fe3+;
(3)步骤Ⅲ中加入Na2CO3溶液的作用是调节溶液的pH,使溶液里的Fe3+完全转化为Fe(OH)3,故答案为:调节溶液的pH;Fe(OH)3;
(4)步骤Ⅲ中加入NaF对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅵ中产生Li2CO3沉淀,故答案为:降低溶液中Li+浓度,避免步骤Ⅵ中产生Li2CO3沉淀;
(5)可通过过滤、洗涤及干燥草酸钴晶体;A为CoC2O4,n(CoC2O4)=$\frac{14.7g}{147g/mol}$=0.1mol,m(Co)=0.1mol×59g/mol=5.9g,则B点时,固体中氧元素的物质的量为n(o)=$\frac{7.5g-5.9g}{16g/mol}$=0.1mol,则钴与氧原子的物质的量之比为0.1mol:0.1mol=1:1,即B点固体物质的化学式为CoO,另外C点氧化物的质量为8.03g,则n(O)=$\frac{14.7g-8.03g}{16g/mol}$=0.133mol,钴与氧原子的物质的量之比为0.1mol:0.133mol=3:4,可知C点固体的化学式为Co3O4,推导出发生反应的化学方程式为6CoO+O2=2Co3O4;故答案为:过滤、洗涤、干燥;CoO;6CoO+O2=2Co3O4.
点评 本题考查了物质提纯和分离的工业制备流程分析判断及运用守恒法的基本计算,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,把握实验过程的分析应用,主要是物质性质的理解应用,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的水溶液中:K+、Ba2+、I-、MnO4- | |
| B. | 使石蕊试液变蓝色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 某澄清溶液中:HCO3-、Na+、Al3+、Br- | |
| D. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 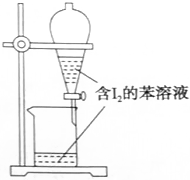 萃萃取碘水中的I2,分出水层的操作 | |
| B. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| C. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| D. | 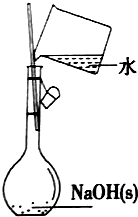 配制0.1mol•L-1的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用Ca(OH)2和NH4Cl制取NH3 | B. | 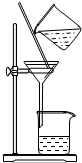 从碘水中提取碘单质 | ||
| C. | 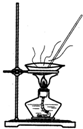 从食盐水中获取氯化钠 | D. | 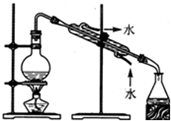 用自来水制取蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | ⅡA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | D | F | |||||
| 3 | A | B | C | E |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA族元素的金属性不一定比ⅡA族元素的金属性强 | |
| B. | VIA族元素的氢化物中,稳定性最好的是H2O | |
| C. | 同周期非金属元素最高价氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KBr+Cl2=2KCl+Br2 | B. | CaCO3=CaO+CO2↑ | ||
| C. | SO3+H2O=H2SO4 | D. | MgCl2+2NaOH=Mg(OH)2↓+2NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com