
�����й�������ȷ���� �� ��
A����Ũ�ȵ�NaClO��NaHCO3�����Һ�У�c��HClO��+c��ClO����= c��HCO ��+c��H2CO3��
��+c��H2CO3��
B��pH��4.5������֭��c��H+����pH=6.5�ķ���֭��c��H+����100��
C��100 ml pH��3��HA��Һ��HB��Һ�ֱ���������п��Ӧ��HA��Һ�ų��������϶࣬˵��HA�����Ա�HB��ǿ
D��pH=5.5��CH3COOH��CH3COONa�����Һ�У�c��Na+��> c��CH3COO����
B
��������
���������A������Ԫ���غ���ɣ�Ӧ��c��HClO��+c��ClO����= c��HCO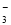 ��+c��H2CO3��+ c��CO32-��������B��pH��4.5������֭��c��H+��=1��10-4.5mol/L��pH=6.5�ķ���֭��c��H+��=1��10-6.5mol/L��ǰ���Ǻ��ߵ�100������ȷ��C��HA��Һ��HB��Һ�������ȣ�������Ũ����ȣ�������п��Ӧ����������HA�࣬˵����HA��Ũ�ȱ���HB��Ũ�ȴ�������������D��CH3COOH��CH3COONa�����Һ��pH=5.5��˵���������̶ȴ��ڴ��������ˮ��̶ȣ�����c��Na+��<c��CH3COO����������ѡB��
��+c��H2CO3��+ c��CO32-��������B��pH��4.5������֭��c��H+��=1��10-4.5mol/L��pH=6.5�ķ���֭��c��H+��=1��10-6.5mol/L��ǰ���Ǻ��ߵ�100������ȷ��C��HA��Һ��HB��Һ�������ȣ�������Ũ����ȣ�������п��Ӧ����������HA�࣬˵����HA��Ũ�ȱ���HB��Ũ�ȴ�������������D��CH3COOH��CH3COONa�����Һ��pH=5.5��˵���������̶ȴ��ڴ��������ˮ��̶ȣ�����c��Na+��<c��CH3COO����������ѡB��
���㣺������Һ���غ���ɵ�Ӧ�ã�pH�ļ��㣬����ǿ�����жϣ�����Ũ�ȵıȽ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014�����з�̨��������ģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ѪҺ�д���ƽ�⣺CO2 + H2O  H2CO3
H2CO3  HCO3�� ��ʹѪҺpH������7.35~7.45֮�䣬����ͻᷢ�����ж�����ж�����֪pH��c(HCO3��)�Uc(H2CO3) �仯��ϵ���±���ʾ��������˵��������ȷ����
HCO3�� ��ʹѪҺpH������7.35~7.45֮�䣬����ͻᷢ�����ж�����ж�����֪pH��c(HCO3��)�Uc(H2CO3) �仯��ϵ���±���ʾ��������˵��������ȷ����
c(HCO3��)��c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A��pH=7��ѪҺ�У�c(HCO3��) > c(H2CO3)
B�����巢�����ж�ʱ���ɾ�����עһ��Ũ�ȵ�NaHCO3��Һ�ⶾ
C�������½�pH=7.40��ѪҺϡ����pH=7ʱ��c(H+)��c(OH��)һ������
D��c(HCO3��)�Uc(H2CO3)=1ʱ��H2CO3�ĵ���̶�С��HCO3����ˮ��̶�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014���ɹŶ�����˹�и�һ��ѧ����ĩ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�˾����˶��������������֯�������㣬������������������������������������  �������ʴ����ѻ����Ȳ�����������ʹ���������������Ե���������
�������ʴ����ѻ����Ȳ�����������ʹ���������������Ե���������
A����B���ʻ� C���Ȼ� D���ǻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014���ɹų���и�����ѧ��4��ͳһ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪������ͬ�¶����ܽ�ȣ�MgCO3��0.02g/100gˮ��Mg(OH)2��0.0009g/100g ˮ��
�� ʱ�������ᣨ
ʱ�������ᣨ ����Ԫ�ᣩ��
����Ԫ�ᣩ�� ��
�� ��
��
���ᣨ ����
���� ��
��
����ͬ�����µ����S2-��������FeS��H2S��CuS,�������ӷ���ʽ������ǣ� ��
A��Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2��+2CaCO3��+2H2O
B��
C�� 
D��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014���ɹų�����������ظ���5��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��15�֣��״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ | ƽ�ⳣ�� | �¶��� | |
500 | 800 | ||
��2H2��g��+CO��g�� | K1 | 2.5 | 0.15 |
��H2��g��+CO2��g�� | K2 | 1.0 | 2.50 |
��3H2��g��+CO2��g�� | K3 |
|
|
��1����Ӧ���� ������ȡ����ȡ�����Ӧ��
��2��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ��P���Ĺ�ϵ����ͼ��ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K��A�� K��B�����>������<�����������ݷ�Ӧ���������Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3�� ����K1��K2��ʾ����

��3����3 L�ݻ��ɱ���ܱ������з�����Ӧ������֪c��CO���뷴Ӧʱ��t�仯��������ͼ��ʾ������t0ʱ�̷ֱ�ı�һ����������������Ϊ����������������
����������Ϊ������ʱ���ı�������� ��
����������Ϊ������ʱ���ı�������� ��

��4���״�ȼ�ϵ�����Ź㷺����;��ͬʱAl��AgO�����Ӧ�ù㷺������ �أ���ԭ �� ����ͼ��ʾ���õ�صĸ�����Ӧʽ�� ��

��5��һ�������¼״���һ����̼��Ӧ���Ժϳ����ᡣͨ��״���£���a mol/L�Ĵ�����b mol/L Ba��OH��2��Һ�������ϣ���Ӧƽ��ʱ��2c��Ba2+��=c��CH3COO�������ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ����ݸ�����ѧ�ڱ�ҵ����ϰͳһ������ۻ�ѧ�Ծ��������棩 ���ͣ������
(15��)���з���ʽΪC10H10O2Br2�ķ����廯����X��X�б��������ĸ�ȡ�����������ϵ�һ������ֻ��һ�֣���˴Ź�������ͼ�����ĸ����շ壬���շ�������Ϊ1:2:6:1����һ�������¿ɷ�������һϵ�з�Ӧ������C�ܷ���������Ӧ��E��FeCl3��Һ��ɫ������Ũ��ˮ��Ӧ��

��֪��
�� ��ϡ����Һ�У����ڱ����ϵ���ԭ�Ӳ�������ˮ��
�������ǻ�ͬʱ����ͬһ̼ԭ���ϵĽṹ�Dz��ȶ��ģ������Զ�������ˮ��Ӧ��
CH3CH(OH) 2��CH3CHO +H2O
�ش��������⣺
��1��X�й������������� ��C�Ľṹ��ʽΪ
��2��E��F��Ӧ������
��3��I�Ľṹ��ʽΪ ��
��4��E�����еĻ�ѧ���� ��ѡ����ţ�
A��ȡ����Ӧ B����ȥ��Ӧ C��������Ӧ D��1molE�������1mol NaHCO3��Ӧ
��5��д�����з�Ӧ�Ļ�ѧ����ʽ��
�� X������ϡNaOH��Һ���ȵĻ�ѧ����ʽ��
�� B��C�Ļ�ѧ����ʽ�� ��
��6��ͬʱ��������������E��ͬ���칹�干�� �֣�
A�������ϵ�һ�ȴ��������֡� B�����ܷ���ˮ�ⷴӦ
C����FeCl3��Һ����ɫ D��1molE����ֱܷ���1molNaOH��2molNa��Ӧ
�����˴Ź�������Ϊ����壬�ҷ������Ϊ3:2:2:1:1:1��һ�ֽṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ����ݸ�����ѧ�ڱ�ҵ����ϰͳһ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��������þ�Ĺ����д������·�Ӧ��

������ͼװ�ö����ղ�����������зֲ����ջ��ռ���

 B��ʢ�ŵ���Һ��D���ռ���������
B��ʢ�ŵ���Һ��D���ռ���������
����ȷ��һ����

A ��NaOH��Һ CO B��Na2CO3��Һ SO2
C�� ϡ���� S D��KMnO4��Һ CO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�߶���ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ������Ũ�ȵĹ�ϵһ����ȷ����
A�� ��
�� ��Һ�У�
��Һ�У�
B��һԪ����MOH��Ӧ����MCl��Һ�У�
C�������ʵ�����һԪ����HX�������KX�Ļ����Һ�У�
D��pH=3��һԪ��HX��pH=11��һԪ��MOH�������ϣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����и�˵���У���ȷ����
A����H>0��ʾ���ȷ�Ӧ����H<0��ʾ���ȷ�Ӧ
B���Ȼ�ѧ����ʽ�еĻ�ѧ������ֻ��ʾ���ʵ����������Ƿ���
C��1 mol H2SO4��1 mol Ba(OH)2��Ӧ����BaSO4����ʱ�ų����Ƚ����к���
D��1 mol H2��0.5 mol O2��Ӧ�ų����Ⱦ���H2��ȼ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com