
【题目】下列物质在氧化还原反应中,硫元素只表现还原性的是( )
A.H2S
B.SO2
C.H2SO3
D.H2SO4
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO- + H2O + 2e- = Cl- + 2OH-,关于该电池的叙述正确的是

A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应为:Mg + ClO- + H2O = Mg(OH)2↓+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用H2S废气制取H2的方法有利于环保。
(l) H2S的电子式是____,H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化如图所示,H2S的电离平衡常数ka1= ___________
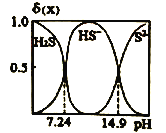
![]()
(2)利用H2S废气制取H2的方法有多种。
①热化学硫碘循环法 已知循环反应如下:
H2S(g)+ H2SO4(aq)═S(s)+ SO2(g)+2 H2O(l)△H1=61 kJ/mol
SO2(g)+I2(g)+2 H2O(l)=2HI(aq)+ H2SO4(aq)△H2=-151 kJ/mol
2HI(aq)= H2(g)+ I2(g)△H3=110kJ/mol
写出硫化氢气体分解为氢气和固体硫的热化学方程式_____。
②高温热分解法
已知:H2S (g) =H2(g)+l/2S2(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为cmol/L,测定H2S的转化率,H2S的平衡转化率与温度关系如图所示。据图可知:温度升高平衡常数K_______(填“增大”、“减小”或“不变”)。若985℃时平衡常数K=0.04,则起始浓度c= ______mol/L 。
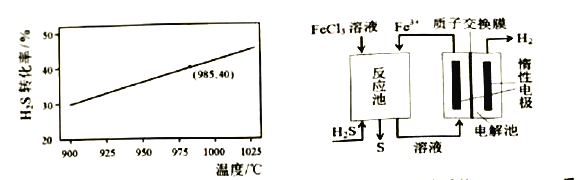
③电化学法 该法制氢过程的示意图如上图。循环利用的物质是____。反应池中化学反应方程式为______。电解池阳极电极反应式为____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火药是中国的“四大”发明,由KNO3和两种非金属元素A和B的单质组成,A为黑色固体,B为淡黄色的固体,则下列有关说法中不正确的是( )
A.元素A与N和O同周期,B与O同主族
B.A,B分别与O组成的化合物AO和BO2均是大气的污染物
C.A和B分别与O组成的化合物均能与烧碱反应
D.单质A在一定条件下可与B的最高价氧化物的水化物发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
(1)写出丙元素的元素符号________,画出丙的原子结构示意图________;
(2)写出乙元素的三种核素符号分别为__________、________、________;
(3)乙、丙两种元素形成的化合物有________。(填化学式)
(4)写出甲、乙、丙三种元素组成的化合物在水中的电离方程式______________。
(5)画出甲元素的离子结构示意图______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 反应的速率影响因素,设计了以下实验,下列说法正确的是
锥形瓶 | 0.1molLNa2S2O3 溶液/mL | 蒸馏水 | 0.2mol/L H2SO4 溶液 | 反应温度 | 浑浊出现时间/s | 备注 |
1 | 10 | 0 | 10 | 20℃ | 10 | |
2 | 10 | 5 | 5 | 20℃ | 16 | |
3 | 10 | 0 | 10 | 50℃ | 5 | 第10 秒开始浑浊不再增多 |
4 | 10 | 6 | 4 | 50℃ | 8 |
A. 该反应也可通过测SO2的体积变化来表示化学反应速率的快慢
B. 3号瓶用Na2S2O3 来表示速率为0.0lmol/(Ls)
C. 由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D. 由1号瓶和4号瓶实验结果可得温度越高反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钠溶液中得到氯化钠固体,选择装置_______ (填代表装置图的字母,下同);除去自来水中的 Cl-等杂质,选择装置________;该分离方法的名称为________.
(2)从碘水中分离出 I2,选择装置_______,该分离方法名称为_____。
(3)装置 A 中①的名称是_______ ,进水的方向是从_______ 口进水.
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
![]()
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用,粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是______(填选项字母)
a.⑤②③①⑥④⑦b.⑤①②③⑥④⑦c.⑤②①③④⑥⑦d.⑤③②①⑥④⑦
加入过量 Na2CO3溶液的目的是除去_____离子,如何判断离子已经沉淀完全_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:
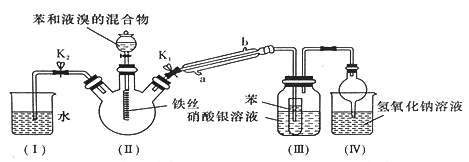
(1)冷凝管所起的作用为冷凝回流蒸气,冷凝水从________(填“a”或“b”)口进入。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始,III中小试管内苯的作用是________________。
(3)能说明苯与液溴发生了取代反应的现象是________________。
(4)反应结束后,要让装置I中的水倒吸入装置II 中,这样操作的目的是__________。四个实验装置中能起到防倒吸的装置有___________。
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;②用5%的NaOH溶液洗涤,振荡,分液;③用蒸馏水洗涤,振荡,分液;④加入无水氯化钙干燥;⑤______________(填操作名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com