
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 7 |
| 1 |
| 7 |
| 1 |
| 2 |
| 1 |
| 2 |
| 4 |
| 7 |
| 3 |
| 7 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
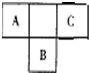 短周期元素的A、B、C在元素周期表中的位置如右图所示,已知A、C 两种元素的原子核外电子数之和等于B的质子数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如右图所示,已知A、C 两种元素的原子核外电子数之和等于B的质子数,B原子核内质子数和中子数相等.据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T | |
| 原子半径(10-10 m) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | |
| 常见化合价 | 最高正价 | +2 | +3 | +6 | +2 | |
| 最低负价 | -2 | -2 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液组成主要成分 | 对应图象 | 溶液中离子浓度关系 | |
| A | NaHCO3 | 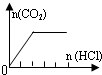 | c(Na+)=c(HCO3-) |
| B | NaHCO3、Na2CO3 | 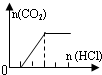 | c(CO32-)<c(HCO3-) |
| C | NaOH、Na2CO3 | 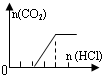 | c(OH-)>c(CO32-) |
| D | Na2CO3 | 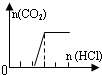 | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com