

| ||
| 2 |
| 5 |
| 100mL |
| 25mL |
| 5 |
| 2 |
| 0.96g |
| 2g |


科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:选择题
可以用分液漏斗进行分离的混合物是
A、酒精和碘水 B、苯和水 C、乙酸和乙酸乙酯 D、乙酸和水
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF) C.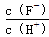 D.
D.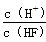
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
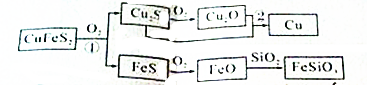
查看答案和解析>>
科目:高中化学 来源: 题型:
 假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )
假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )| A、假蜜环菌甲素可以发生消去反应 |
| B、1 mol假蜜环菌甲素可与 6 molH2发生加成反应 |
| C、假蜜环菌甲素可与 NaOH 溶液在加热条件下发生水解反应 |
| D、假蜜环菌甲素既能与Na反应生成H2,又能与NaHCO3反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=4.7浓度均为0.1mol?L-1的CH2COOH、CH3COONa混合溶液中,c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| B、常温下,氨水与(NH4)2SO4溶液混合所得pH=7的溶液中,c(NH4+):c(SO42-)=2:1 |
| C、将体积相同,pH均为1的盐酸和醋酸分别加水稀释至pH=3,盐酸的体积变化大,证明醋酸是弱酸 |
| D、向2.0ml浓度均为0.1mol?L-1的KCl、KI混合液中滴加1-2滴0.01mol?L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
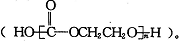 下列有关说法不正确的是( )
下列有关说法不正确的是( )| A、乙二醇可作汽车抗冻液 |
| B、减少CO2的排放可防止酸雨 |
| C、该塑料是一种有机高分子材料 |
| D、链节上酯基的水解有利于降解发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
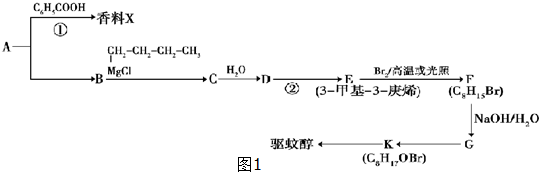
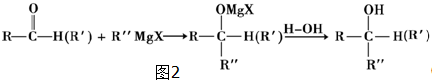
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com