
下列储存药品的方法中,正确的是
A.浓硫酸保存在橡胶塞试剂瓶中
B.浓硝酸保存在无色试剂瓶中
C.金属钠保存在煤油中
D.氢氧化钠溶液保存在玻璃塞试剂瓶中
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(金属)(解析版) 题型:选择题
向NaHSO3溶液中加入足量Na2O2粉末,充分反应后溶液中离子浓度减少的是(忽略溶液体积变化)
A.Na+ B.SO32- C.OH- D.SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学常见有机物性质与结构(解析版) 题型:选择题
下列说法正确的是
.糖类化合物都具有相同的官能团
B.酯类物质是形成水果香咪的主要成分
C.油脂的皂化反应生成脂肪酸和丙醇
D.蛋白质的水解产物都含有羧基和羟基
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学工业流程图分析(解析版) 题型:填空题
垃圾焚烧发电产生的烟气中含烟尘、二氧化硫、氮氧化物、氯化氢等有害物质,处理流程如下:
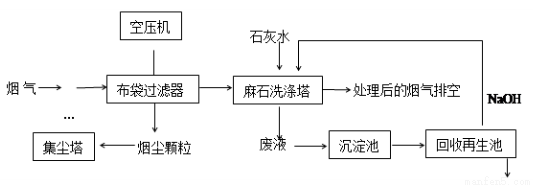
(1)麻石洗涤塔中设置多层格栅,上面放置大量耐酸碱塑料小球,塔内设置多层上喷下淋水嘴,“烟气”从塔底进入,目的是 。
(2)若NO2和NO气体以物质的量之比1:1混合通入石灰水中,发生氧化还原反应生成一种正盐和水,请写出反应的化学方程式 ;已知此正盐的水溶液呈碱性,用离子方程式表示 。
(3)废液在沉淀池中慢慢沉降,沉淀主要含 ;在回收再生池中加入NaOH固体的作用是 。
(4)环境检测部门测量处理前后烟气中烟尘的含量见下表:
项目 | 监测结果 | 国标号 | |
处理前 | 处理后 | GWKB3—2000 | |
烟尘(mg/m3) | 13929.0 | 61.0 | 80 |
其获得监测结果中的数据使用的测定方法为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学工业流程图分析(解析版) 题型:填空题
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂,它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液c(Fe3+)=4.0×10-5mol/L,则需要调整到 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定,放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验药品保存、基本操作、检验(解析版) 题型:选择题
下列实验中,所采取的分离方法与对应原理都正确的是
选项 | 目的 | 分离方法 | 原理 |
A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:填空题
王老师在用酒精喷灯做“铁与水蒸气反应”后,该校高一化学研究性小组同学对得到的黑色固体物质进行了如下实验:

(1)甲同学认为:该黑色固体为四氧化三铁。请写出黑色固体溶于稀盐酸的化学方程式____________;
(2)乙同学提出:根据上述实验现象甲同学的观点不可靠,理由是__________;
(3)深红色溶液C放置一段时间后,发现红色褪去。关于溶液褪色的原因,同学们纷纷猜想:
假设一:氯水有强氧化性,将溶液中的SCN—氧化;
假设二:空气中有还原性物质,将 ;
假设三:氯水有极强的氧化性,将 ;
基于假设一,为验证合理与否,可选用试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0mol·L-1NaOH、0.lmol·L-1FeC13、0.lmol·L-1 CuSO4、20%KSCN、蒸馏水。
实验操作 | 预期现象 | 结论 |
取少量褪色后的溶液,
|
| 说明假设一是合理的 |
(4)乙同学用酒精灯加热做铁与水蒸气反应的实验,也得到了黑色固体,它不能被磁铁吸引,当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色。由此她认为生成该固体的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学守恒及离子浓度大小的比较(解析版) 题型:选择题
25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述,正确的是
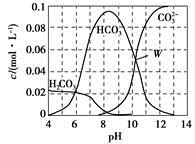
A.W点所示的溶液中:c(Na+)+c(H+)=2c(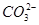 )+c(OH-)+c(Cl-)
)+c(OH-)+c(Cl-)
B.pH=4的溶液中:c(H2CO3)+c(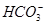 )+c(
)+c(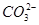 )<0.1 mol·L-1
)<0.1 mol·L-1
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(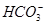 )=c(OH-)+c(Cl-)
)=c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(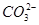 )>c(
)>c(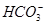 )>c(H2CO3)
)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学原电池的工作原理、电极反应式的书写(解析版) 题型:选择题
在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
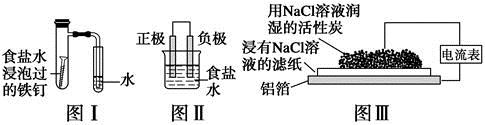
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com