
| A. | Na+、CO32- | B. | Na+、HCO3- | C. | CO32-、HCO3- | D. | Na+、OH- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
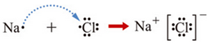
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| I | 0.2 | 0.2 | pH=a |
| II | c1 | 0.2 | pH=7 |
| III | 0.2 | 0.1 | pH>7 |
| IV | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的物质的量浓度为2mol/L | |
| B. | CaCl2的物质的量为1mol | |
| C. | 取出50 mL后,剩余溶液中CaCl2的物质的量浓度为0.5mol/L | |
| D. | 该溶液中水的体积为100 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  图可表示对平衡N2(g)+3H2(g)?2NH3(g)加压、同时移除部分NH3时的速率变化 | |
| B. |  图中a、b曲线只可表示反应H2(g)十I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 | |
| C. | 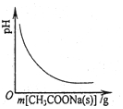 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 | |
| D. | 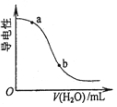 图表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a<b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com