
| A. | 碘的升华 | B. | 石油分馏 | ||
| C. | 用苯萃取溴水中的溴 | D. | 煤的干馏 |
分析 物质的性质的异同决定着分离操作方法,可根据分离方法确定物质是否发生化学反应,题中升华是利用物质的物理性质,分馏、萃取都是利用沸点的不同,也属于物理性质,干馏是隔绝空气加强热发生复杂的物理化学变化的过程,以此解答.
解答 解:A.升华是利用物质在加热时直接由固体变为气体进行分离,只是状态的变化,属于物理变化,故A错误;
B、分馏是利用沸点的不同进行分离,属于物理变化,故B错误;
C、用苯萃取溴水中的溴是利用了溴单质在苯中溶解性大于水进行分离,属于物理变化,故C错误;
D、煤的干馏是隔绝空气加强热发生复杂的物理化学变化的过程,涉及到化学变化,故D正确.
故选D.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力的考查,为高频考点,注意把握物质的性质的异同,为解答该题的关键,难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
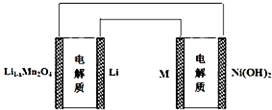
| A. | 锂离子电池放电时Li+向正极迁移 | |
| B. | 锂离子电池充电时,阴极的电极反应式:LiMn2O4-xe-═Li1-xMn2O4+xLi+ | |
| C. | 如图表示用锂离子电池给镍氢电池充电 | |
| D. | 镍氢电池放电时,负极的电极反应式:MH+OH--e-═H2O+M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
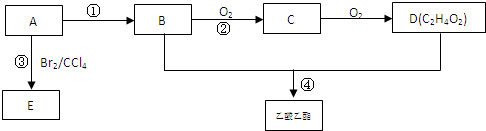
 CH3COOCH2CH3+H2O:反应类型:酯化反应.
CH3COOCH2CH3+H2O:反应类型:酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 1 mol该化合物和足量的钠反应生成1 mol H2 | |
| C. | 能与溴发生取代反应和加成反应 | |
| D. | 1 mol该化合物最多与2 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 反应物的总能量比生成物的总能量大 | |
| C. | 氢氧化钠与盐酸的反应属于吸热反应 | |
| D. | CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
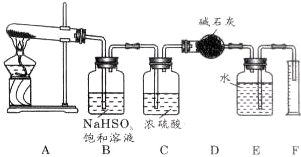
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体一定是CH4和C2H4 | |
| B. | 混合气体中一定有CH4,可能含有C2H4 | |
| C. | 混合气体中一定含有CH4,可能含有C2H6 | |
| D. | 混合气体中可能含有C2H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com