



 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:阅读理解
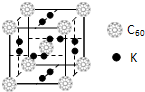
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?湖南二模)[化学一选修化学与技术]
(2011?湖南二模)[化学一选修化学与技术]
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
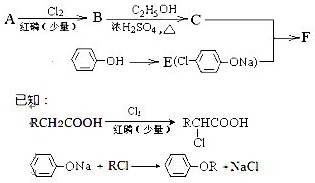
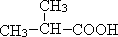
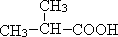


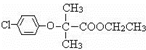

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com