

分析 (1)根据题干信息,磷化铝水解生成氢氧化铝和磷化氢;
(2)PH3为共价化合物,在气态时只存在分子,HgCl2溶于水,所得溶液几乎不导电,说明HgCl2在溶液中没有溶质离子,在水中不电离,属于共价化合物,但磷化氢与HgCl2作用,生成HCl,所以可通过测定溶液的PH或通过测定溶液的电导率的变化,可准确测定空气中微量的PH3;
(3)①与足量的NaOH溶液反应生成亚磷酸钠,化学式为Na2HPO3,可说明H3PO3为二元酸;
②该反应的反应物为黄磷、氢氧化钠,产物为次磷酸钠、亚磷酸钠、磷化氢,根据n(NaH2PO2):n(Na2HPO3)=3:1和得失电子守恒书写方程式,根据方程式判断参加反应的n(P4):n(NaOH)比;
(4)漂白粉主要成分为CaCl2、Ca(ClO)2,具有氧化性的是Ca(ClO)2,将PH3氧化为H3PO4,反应物为Ca(ClO)2、PH3,生成物为H3PO4、CaCl2,据此书写方程式,含有水蒸气时,次氯酸根离子水解生成碱中和酸能使氧化PH3加快;
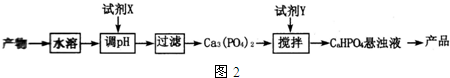
(5)①根据流程,加入试剂得到磷酸钙,所以试剂X含有钙离子,加入试剂能够中和磷酸氢钙中的氢,需加入碱,或氧化物与水反应生成碱,据此分析选择X;
②CaHPO4为强碱弱酸酸式盐,若水解大于电离,为碱性,若电离大于水解呈酸性,据此分析解答.
解答 解:(1)AlP和水反应时,生成PH3和Al(OH)3沉淀,化学方程式为:AlP+3H2O=Al(OH)3+PH3↑,
故答案为:AlP+3H2O=Al(OH)3+PH3↑;
(2)电导率可衡量电解质溶液导电能力大小,PH3为共价化合物,在气态时只存在分子,HgCl2在熔融状态下不能导电,属于共价化合物,磷化氢与HgCl2作用,PH3+3HgCl2═P(HgCl)3↓+3HCl,生成的氯化氢在溶液中呈酸性,为强酸,所以可通过测定溶液的PH或电导率来准确测定空气中微量的PH3,HgCl2溶于水,所得溶液几乎不导电,说明在水中不电离,HgCl2属于共价化合物,
故答案为:PH或电导率;共价;
(3)①H3PO3,1mol分子含有3mol氢原子,但黄磷与足量的NaOH溶液反应只生成Na2HPO3,可说明H3PO3为二元酸,不是三元酸,
故答案为:二;
②该反应的反应物为黄磷、氢氧化钠,产物为次磷酸钠、亚磷酸钠,P4中(P为0价),NaH2PO2中(P为+1价),Na2HPO3(P为+3价),PH3(P为-3价),当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,根据得失电子守恒,n(NaH2PO2):n(Na2HPO3):n(PH3)=3:1:2,反应为:3P4+10NaOH=6NaH2PO2+2Na2HPO3+4PH3↑,所以参加反应的n(P4):n(NaOH)=3:10,
故答案为:3:10;
(4)漂白粉主要成分为CaCl2、Ca(ClO)2,具有氧化性的是Ca(ClO)2,将PH3氧化为H3PO4,反应为2Ca(ClO)2+PH3=H3PO4+2CaCl2,含有水蒸气时,次氯酸根离子水解生成次氯酸ClO-+H2O?HClO+OH-,生成的碱中和酸,加快PH3的氧化过程,
故答案为:2Ca(ClO)2+PH3=H3PO4+2CaCl2;ClO-+H2O?HClO+OH-;
(5)①根据流程,加入试剂得到磷酸钙,所以试剂X含有钙离子,加入试剂能够中和磷酸氢钙中的氢,需加入Ca(OH)2,CaO与水反应生成Ca(OH)2,所以X可以为Ca(OH)2或CaO,
故答案为:Ca(OH)2或CaO;
②CaHPO4为强碱弱酸酸式盐,CaHPO4的电离Ka(HPO42-)=$\frac{c({H}^{+})•c(P{{O}_{4}}^{2-})}{C(HP{{O}_{4}}^{2-})}$=4.4×10-13;水解,K水解(HPO42-)=$\frac{C({H}_{2}P{{O}_{4}}^{-})•C(O{H}^{-})}{C(HP{{O}_{4}}^{2-})}$=$\frac{1.0×1{0}^{-14}}{6.3×1{0}^{-8}}$>Ka(HPO42-);水解程度大于电离程度,溶液呈碱性,
故答案为:>;Ka(HPO42-)=$\frac{c({H}^{+})•c(P{{O}_{4}}^{2-})}{C(HP{{O}_{4}}^{2-})}$=4.4×10-13;K水解(HPO42-)=$\frac{C({H}_{2}P{{O}_{4}}^{-})•C(O{H}^{-})}{C(HP{{O}_{4}}^{2-})}$=$\frac{1.0×1{0}^{-14}}{6.3×1{0}^{-8}}$>Ka(HPO42-);水解程度大于电离程度,溶液呈碱性.
点评 本题考查磷及其化合物的有关知识,侧重考查了氧化还原、盐类的水解应用,掌握磷化氢、磷酸、亚磷酸及其酸式盐的性质是解答关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 100g 30% CH3COOH溶液中含氢原子数为2NA | |
| B. | 标准状况下,11.2 L CCl4中含有C-Cl键的数目为2NA | |
| C. | 16gO3和O2混合物中含氢原子数为NA | |
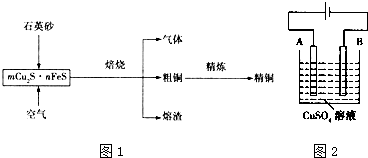
| D. | 精炼铜过程中阳极质量减少6.4g时,电路中转移电子数等于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
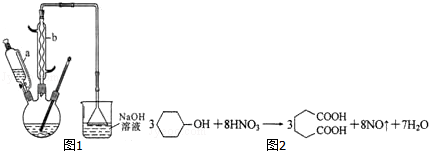
| 物质 | 密度 | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
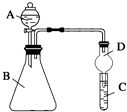 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
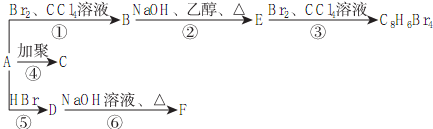
 ,D
,D ,E
,E .
.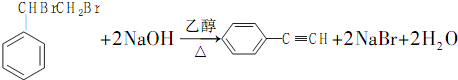 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com