
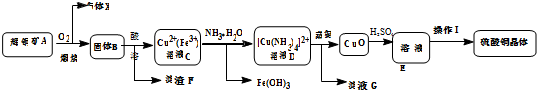
分析 (1)根据图示,Cu2S与O2的反应为氧化还原反应生成铜和二氧化硫;
(2)固体B为氧化物组成的混合物,酸溶时加入稀硫酸和H2O2,目的是溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;根据浓硫酸氧化Fe2+反应会生成对环境有污染的SO2;
(3)根据三价铁与KSCN溶液出现血红色,证明Fe3+是否完全除尽;根据溶液的组成判断滤液G的主要溶质;
(4)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、过滤、洗涤、烘干.
(5)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,写出离子方程式;据比例关系4CuSO4•5H2O~4Cu2+~2I2~4S2O32-计算.
解答 解:(1)根据图示,Cu2S与O2的反应为氧化还原反应生成铜和二氧化硫,方程式为:Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2CuO+SO2,所以气体X是SO2;
故答案为:SO2;Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2CuO+SO2;
(2)固体B为氧化物组成的混合物,酸溶时加入稀硫酸和H2O2,目的是溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;因为浓硫酸氧化Fe2+反应会生成对环境有污染的SO2,所以不用;故答案为:溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;浓硫酸与Fe2+反应会生成对环境有污染的SO2;
(3)因为三价铁与KSCN溶液出现血红色,所以取少量D溶液于试管中,滴入KSCN溶液,若溶液未出现血红色,则证明Fe3+完全除尽;因为溶液D中含有[Cu(NH3)4]2+和硫酸根,所以D转化生成CuO后,剩余的溶液中含有(NH4)2SO4;
故答案为:取少量D溶液于试管中,滴入KSCN溶液,若溶液未出现血红色,则证明Fe3+完全除尽;(NH4)2SO4;
(4)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、过滤、洗涤、烘干,
故答案为:过滤、洗涤;
(5)①硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,离子方程式为:2Cu2++4I-=2CuI↓+I2,故答案为:2Cu2++4I-=2CuI↓+I2;
②据比例关系4CuSO4•5H2O~4Cu2+~2I2~4S2O32-,
c×V×10-3mol c×V×10-3mol
试样中CuSO4•5H2O的质量分数为$\frac{cV×1{0}^{-3}×250}{a}$×$\frac{100mL}{25mL}$×100%=$\frac{100cV}{a}$%,故答案为:$\frac{100cV}{a}$%.
点评 本题考查了物质分离提纯的方法和流程判断,主要是物质性质的理解应用和实验基本操作,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华.另外茶叶中还含有11%~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿.现从茶叶中提取咖啡碱流程如下:
茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华.另外茶叶中还含有11%~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿.现从茶叶中提取咖啡碱流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小 | |
| B. | H2A溶液在不同pH环境中各微粒的分布不同,电离平衡常数也不同 | |
| C. | 溶液的pH=4.5时,存在如下关系:C(Na+)>C(HA-)>C(A2-)>C(H+)>C(OH-) | |
| D. | 已知HClO的电离平衡常数为10-7.5将少量H2A 的溶液加入足量NaClO溶液中,发生的反应为:H2A+ClO-═HClO+HA- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加甲基橙试剂呈红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | pH为11的溶液:S2-、SO32-、S2O32-、Na+ | |
| C. | 水电离出来的c (OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 无色透明的溶液:K+、SiO32-、NO3-、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com