
【题目】由丙烯经下列反应制得F、G两种高分子化合物,它们都是常用的塑料。
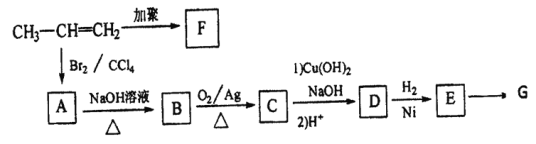
(1)F的结构简式为________。
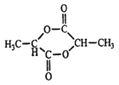
(2)在一定条件下,两分子E能脱去两分子形成一种六元环状化合物,该化合物的结构简式为_______。
(3)①B→C 化学方程式为______。
②C与含有NaOH的Cu(OH)2悬浊液反应的化学方程式为______。
③E→G化学方程式为______。
(4)手性分子X为E的一种同分异构体,lmolX与足量金属钠反应产生lmol氢气,lmolX与足量银氨溶液反应能生成2molAg,则X的结构简式为_______。
(5)用G代替F制成一次性塑料餐盒的优点是_______。
【答案】![]()
![]()
![]()

![]() 聚乳酸制成的塑料在自然环境中可以降解为小分子,对环境无害。
聚乳酸制成的塑料在自然环境中可以降解为小分子,对环境无害。
【解析】
丙烯发生加聚反应生成F,F是聚丙烯;丙烯与溴发生加成反应生成A,A是1,2-二溴丙烷;A水解为B,B是1,2-丙二醇;B氧化为C,C是![]() ;
;![]() 被新制氢氧化铜悬浊液氧化为D,D是
被新制氢氧化铜悬浊液氧化为D,D是![]() ;
;![]() 与氢气发生加成反应生成E,E是
与氢气发生加成反应生成E,E是![]() ;
;![]() 发生缩聚反应生成高分子化合物G为
发生缩聚反应生成高分子化合物G为 。
。
(1) 丙烯发生加聚反应生成F,F是聚丙烯,结构简式为![]() 。
。
(2)E是![]() ,在一定条件下,两分子
,在一定条件下,两分子![]() 能脱去两分子水形成一种六元环状化合物,该化合物的结构简式为
能脱去两分子水形成一种六元环状化合物,该化合物的结构简式为 。
。
(3)①B是1,2-丙二醇被氧化为![]() , 化学方程式为
, 化学方程式为![]() 。
。
②C是![]() ,被含有NaOH的Cu(OH)2悬浊液氧化为
,被含有NaOH的Cu(OH)2悬浊液氧化为![]() ,反应的化学方程式为
,反应的化学方程式为![]() 。
。
③E是![]() ,发生缩聚反应生成聚乳酸,化学方程式为
,发生缩聚反应生成聚乳酸,化学方程式为 。
。
(4)手性分子X为E的一种同分异构体,lmolX与足量金属钠反应产生lmol氢气,lmolX与足量银氨溶液反应能生成2molAg,说明X中含有2个羟基、1个醛基,则X的结构简式为![]() 。
。
(5)用G代替F制成一次性塑料餐盒的优点是聚乳酸制成的塑料在自然环境中可以降解为小分子,对环境无害。


科目:高中化学 来源: 题型:
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O42H2O)
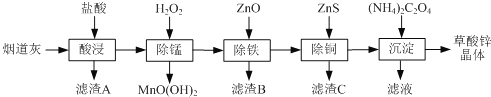
已知:常温下Ksp[Fe(OH)3]=2.6×10-39, Ksp[Cu(OH)2]=2.2×10-20。
请问答下列问题:
(1)为了提高“酸浸”时锌元素的浸出率,可以采取的措施有:_________、________(填写2条)。
(2)“除锰”反应后,溶液的pH__________(填“增大”“减小”或“不变”)。
(3)常温下“除铁”反应中,加入ZnCO3可调节溶液的pH,使得Fe3+和部分Cu2+被除去,当两种沉淀共存且溶液的pH=8时,c(Cu2+)/ c( Fe3+)=________________ 。
(4)“除铜”反应的离子方程式为________。
(5)若“沉淀”过程中采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,应该在搅拌下,将Na2C2O4溶液缓慢加入ZnCl2溶液中,如果顺序颠倒,会产生的不良后果是__________。
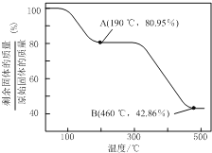
(6)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率(剩余固体的质量/原始固体的质量×100%)随温度的变化如图所示,则A、B点固体的化学式分别为____、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )
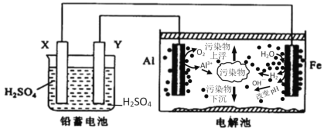
A.X电极质量减轻,Y电极质量增加
B.电解池阳极上被氧化的还原剂有Al和H2O
C.电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.每消耗103.5gPb,理论上电解池阴极上有1molH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化合物YX2和ZX2中,已知X、Y、Z都是前三周期的元素,X与Y同周期,Y与Z同主族,Y原子的最外层电子数是次外层电子数的2倍;X原子最外层上有6个电子。根据以上条件,回答问题:
(1)Y的原子结构示意图为___。
(2)YX2的结构式是___,分子内的共价键是___(填“极性键”或“非极性键”)。
(3)ZX2的化学式为___。
(4)用电子式表示YX2的形成过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.石油裂解气可以使溴水褪色,也可以使高锰酸钾溶液褪色
B.可以用溴水检验乙烷中是否含有乙烯
C.1 mol 甲烷在光照条件下最多能与 2 mol Cl2发生取代反应
D.CH2=CHCH3+Cl2![]() CH2=CHCH2Cl+HCl属于取代反应
CH2=CHCH2Cl+HCl属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼是一种典型的超硬无机材料,常以BCl3、PH3为原料制备。回答下列问题:
(1)基态P原子与B原子中未成对电子数之比为___。
(2)与BC13分子互为等电子体的一种离子为___(填化学式)。
(3)PH3分子的立体结构为___;PH3的沸点___(填“高于”或“低于”)NH3,理由是___。
(4)BCl3、PCl3和PF3三种分子中键角由大到小的顺序为___。
(5)BCl3可转化为硼酸,硼酸为一元强酸的原因是___(用离子方程式表示)。
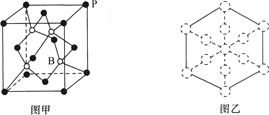
(6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子,晶胞中P原子空间堆积方式为___。已知磷化硼晶体的密度为ρg·cm-3,设阿伏加德罗常数的值为NA,则晶胞中B原子与P原子间最短距离为___pm。若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),请在图乙中用实线圆圈画出B原子的投影位置___(注意原子体积的相对大小)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁腈橡胶(![]() )具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是
)具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是
①CH2=CH-CH=CH2 ②CH3-C≡C-CH3 ③CH2=CH-CN ④CH3-CH=CHCN ⑤CH3-CH=CH2 ⑥CH3-CH=CH-CH3
A. ①③B. ③⑥C. ②③D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质工业制备的说法中正确的是
A.接触法制硫酸时,在吸收塔中用水来吸收三氧化硫获得硫酸产品
B.工业上制备硝酸时产生的NOx,一般可以用NaOH溶液吸收
C.从海水中提取镁的过程涉及化合、分解、置换、复分解等反应类型
D.工业炼铁时,常用焦炭做还原剂在高温条件下还原铁矿石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如右图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是
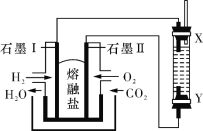
A. 石墨电极Ⅱ处的电极反应式为O2+4e-=2O2-
B. X是铁电极
C. 电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L
D. 若将电池两极所通气体互换,X、Y两极材料也互换, 实验方案更合理。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com