
| A. | 该电池的电解质溶液为酸性 | B. | 电池总反应为2H2+O2=2H2O | ||
| C. | X极是负极,发生氧化反应 | D. | 电池工作一段时间后溶液PH增大 |
分析 根据燃料电池的工作原理和规律:氢氧燃料电池是将化学能转变为电能的装置,工作时,通入燃料氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水.
解答 解:A、根据燃料电池中,X极:O2(g)+2H2O(l)+4e-=4OH-,则该电池的电解质溶液为碱性,故A错误;
B、电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,则电池总反应为2H2+O2=2H2O,故B正确;
C、通入燃料氢气的一极为电池的负极,发生氧化反应,即Y极是负极,发生氧化反应,故C错误;
D、根据以上分析,电池的电解质溶液为碱性,又电池工作一段时间后生成水,稀释了碱,则溶液PH减小,故D错误.
故选B.
点评 本题考查学生燃料电池的工作原理以及电极反应方程式的书写知识,属于基本知识的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢的电子式: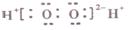 | |
| B. | 比例模型  既可以表示甲烷分子,也可以表示四氯化碳分子 既可以表示甲烷分子,也可以表示四氯化碳分子 | |
| C. | 次氯酸的结构式H-O-Cl | |
| D. | 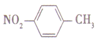 表示对硝基甲苯的结构简式 表示对硝基甲苯的结构简式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1:c2=3:1 | |
| B. | 平衡时.Y和Z的生成速率之比为2:3 | |
| C. | X、Y的转化率不相等 | |
| D. | c1 的取值范围为 0 mol/L<c1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题:
A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题: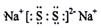 ,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.
,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com