
| A. | 通直流电后,溶液中溶质分子分别向两极移动,而胶体中分散质粒子向某一极移动 | |
| B. | 向Fe(OH)3胶体中不断滴加稀硫酸,最终胶体聚沉产生红褐色沉淀 | |
| C. | 硫酸铜溶液通过一束光无特殊现象,淀粉溶液中通过一束光侧面出现一条光亮的通路 | |
| D. | 溶液中溶质粒子的运动有规律,胶体粒子运动无规则 |
分析 A、通电时溶质电离出的阴阳离子分别移向两极,溶质是非电解质时不移向任何电极;
B、向Fe(OH)3胶体中不断滴加稀硫酸,胶体聚沉产生红褐色沉淀,随后氢氧化铁沉淀会溶于硫酸中;
C、胶体具有丁达尔现象,溶液不具备;
D、胶体的分散质粒子具有布朗运动特性,溶液中溶质分子运动无规律.
解答 解:A、通电时,溶液中的溶质粒子是电解质,电离出的阴阳离子分别向两极移动,若溶质是非电解质不移向电极,胶体中的分散质粒子向某一极移动,故A错误;
B、向Fe(OH)3胶体中不断滴加稀硫酸,胶体聚沉产生红褐色沉淀,随后氢氧化铁沉淀会溶于硫酸中,不会存在红褐色的沉淀,故B错误;
C、胶体具有丁达尔现象,溶液不具备,所以硫酸铜溶液通过一束光无特殊现象,淀粉溶液中通过一束光侧面出现一条光亮的通路,故C正确;
D、胶体的分散质粒子在显微镜观察下呈现无规则运动,这就是胶体的布朗运动特性,溶液中的离子呈现自由态,其运动是无规律可言的,故D错误;
故选C.
点评 本题考查了胶体、溶液的性质区别,注意胶体粒子的吸附离子作用,要学会知识的迁移应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、MnO4-、SO42- | |
| B. | I-、Na+、NO3-、ClO- | |
| C. | Mg2+、Na+、NO3-、SO42- | |
| D. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| B. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| C. | 浓硫酸不慎滴到皮肤上,先用较多的水冲洗,再涂上3%~5%的碳酸氢钠溶液 | |
| D. | 除去粗盐中的硫酸盐应加入BaCl2溶液,离子反应为Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各能层含有电子数为2n2 | |
| B. | 各能层的能级都是从s能级开始至f能级结束 | |
| C. | 各能层含有的能级数为n-l | |
| D. | 各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ka1 | Ka2 | |
| H2A | 1.3×10-2 | 6.3×10-6 |
| H2B | 4.2×10-7 | 5.6×10-7 |
| A. | H2A的电离方程式:H2A═2H++A2- | |
| B. | 常温下,在水中Na2B的水解平衡常数为:Ka1=$\frac{K_W}{{4.2×{{10}^{-7}}}}$ | |
| C. | 等浓度的Na2A和Na2B溶液,由水电离产生的H+浓度大小关系为:前者大于后者 | |
| D. | 向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A=A2-+H2B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | l:2 | C. | l:1 | D. | 3:l |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (或
(或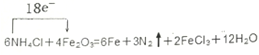 );
);查看答案和解析>>
科目:高中化学 来源: 题型:填空题
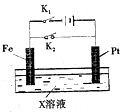 如图是一个电化学过程的示意图,请回答下列问题:
如图是一个电化学过程的示意图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
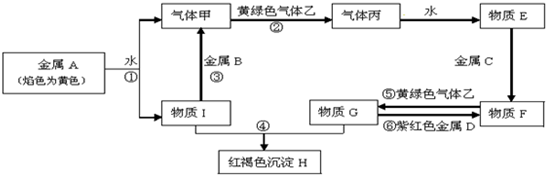
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com