
| A. | 未加NaOH溶液时,c(H+)>c(CI-)═c(CH3COOH) | |
| B. | 加入10mLNaOH溶液时:c(CH3COO-)+c(OH-)═c(H+) | |
| C. | 加入NaOH溶液至PH=7时:c(Na+)═c(CI-) | |
| D. | 加入20mLNaOH溶液时:c(Na+)═c(CH3COO-)+c(CI-) |
分析 A.未加NaOH时,浓度均为0.1mol•L-1的HC1和CH3COOH混合溶液中,盐酸完全电离,醋酸部分电离;
B.加入l0mLNaOH时,酸全部反应,得到等浓度氯化钠和醋酸的混合物,根据溶液中的质子守恒来回答;
C.恰好反应时生成氯化钠和醋酸钠,醋酸根离子发生水解,溶液呈碱性,结合电荷守恒判断;
C.加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠的混合物,根据电荷守恒来回答.
解答 解:A.未加NaOH时,浓度均为0.1mol•L-1的HC1和CH3COOH混合溶液中,盐酸完全电离,醋酸部分电离,c(H+)>c(Cl-)>c(CH3COOH),故A错误;
B.加入l0mLNaOH时,酸全部反应,得到等浓度的氯化钠和醋酸的混合物,氯化钠中钠离子和氯离子浓度相等,溶液中存在质子守恒:c(OH-)+c(CH3COO-)=c(H+),故B正确;
C.加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠的混合物,醋酸根离子部分水解,溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒可知:c(Na+)>c(Cl-),故C错误;
D.加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠的混合物,根据物料守恒可得:2c(CH3COOH)+2c(CH3COO-)=c(Na+),故D错误;
故选B.
点评 本题考查了酸碱混合的定性判断及溶液中离子浓度定性比较,题目难度中等,注意掌握酸碱混合后溶液酸碱性的判断方法,明确电荷守恒、物料守恒的含义,能够根据溶液中守恒关系判断各离子浓度大小,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
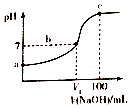 已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )
已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )| A. | a点溶液的pH=4 | |
| B. | b点溶液中存在:c(A-)>c(Na+)>c(H+)=c(OH-) | |
| C. | b点c(HA)/c(A-)=5 | |
| D. | c点c(A-)+c(H+)=c(Na+)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将浓硝酸加入盛有铂、金的烧杯中,不反应,再加入一定量浓盐酸后,铂、金溶解,不能说明浓硝酸氧化性比浓盐酸强 | |
| B. | 石英玻璃、普通玻璃、陶瓷及水泥均属于硅酸盐产品 | |
| C. | 电解AlCl3水溶液,阴极周围出现白色胶状沉淀,说明Al(OH)3胶体粒子带正电荷 | |
| D. | 气体甲通入溶液乙,溶液乙的颜色褪去,说明气体甲具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
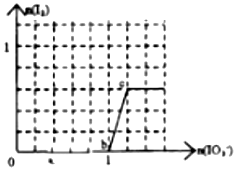 己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | 0~a间发生反应:3HSO3-+IO3-═3SO42-+I-+3H+ | |
| B. | a~b间共消耗NaHSO3的物质的量为1.8mol | |
| C. | b~c间反应:I2仅是氧化产物 | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的KIO3为1.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:X<W<Z | |
| B. | W、X、Y元素形成的盐溶于水,溶液一定呈中性 | |
| C. | W与X形成的常见化合物中阴、阳离子个数比均为1:2 | |
| D. | 1 mol Z 的单质与足量的NaOH溶液反应转移电子数1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | - |
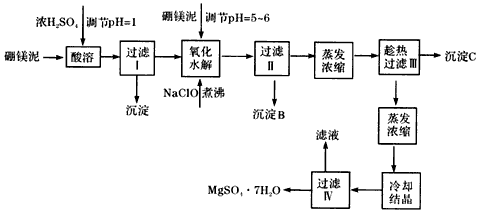
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
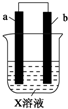 下列对如图所示装置实验现象的描述错误的是( )
下列对如图所示装置实验现象的描述错误的是( ) | a电极 | b电极 | X溶液 | |
| ① | Cu | Zn | CuCl2 |
| ② | Zn | 石墨 | HCl |
| A. | 实验①中a极质量增加 | B. | 实验①中Cl-离子向正极移动 | ||
| C. | 实验②a极质量减少 | D. | 实验②中b极放出无色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com