铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物.
(1)要确定铁的某氯化物FeCl
x的化学式,可用离子交换和滴定的方法.实验中称取0.54g FeCl
x样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH
-的阴离子交换柱,使Cl
-和OH
-发生交换.交换完成后,流出溶液的OH
-用0.40mol?L
-1的盐酸滴定,滴至终点时消耗盐酸25.0mL.计算该样品中氯的物质的量,并求出FeCl
x中的x值:
n(OH
-)=n(H
+)=n(Cl
-)=0.0250L×0.40 mol?L
-1=0.010 mol,
×x=0.010mol,x=3
n(OH
-)=n(H
+)=n(Cl
-)=0.0250L×0.40 mol?L
-1=0.010 mol,
×x=0.010mol,x=3
(列出计算过程)
(2)现有一含有FeCl
2和FeCl
3的混合物的样品,采用上述方法测得n(Fe)﹕n(Cl)=1﹕2.1,则该样品中FeCl
3的物质的量分数为
10%
10%
.在实验室中,FeCl
2可用铁粉和
盐酸
盐酸
反应制备,FeCl
3可用铁粉和
氯气
氯气
反应制备;
(3)FeCl
3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
2Fe3++2I-=2Fe2++I2
2Fe3++2I-=2Fe2++I2
.
(4)高铁酸钾(K
2FeO
4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl
3 和KClO在强碱性条件下反应可生成K
2FeO
4,其反应的离子方程式为
2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
.与MnO
2-Zn电池类似,K
2FeO
4-Zn也可以组成碱性电池,K
2FeO
4在电池中作为正极材料,其电极反应式为
FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-
FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-
.该电池总反应的离子方程式为
3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-
3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-
.

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案 如图为“在实验室中制取氯气”的装置图:
如图为“在实验室中制取氯气”的装置图: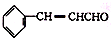 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
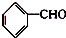
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的: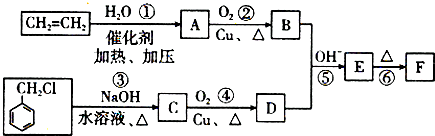
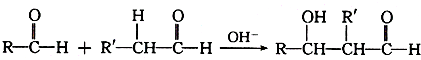

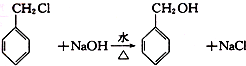

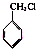 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是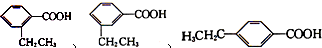 三种任写一种即可
三种任写一种即可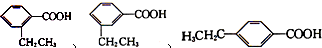 三种任写一种即可
三种任写一种即可