
【题目】将0.1 mol·L-1的下列物质的水溶液,从常温加热到90 ℃,溶液的pH几乎不变的是(不考虑水的蒸发)( )
A. 氯化钠 B. 氢氧化钾 C. 硫酸 D. 硫酸铵
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
①CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
②CO(g)+1/2O2(g)![]() CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1
③H2(g)+1/2O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2 (g)![]() CH3OH(g) ΔH=________ kJ·mol-1。
CH3OH(g) ΔH=________ kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号)。
a. 使用高效催化剂 b. 降低反应温度
c. 增大体系压强 d. 不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_______;
③100℃时,达到平衡后,保持压强P1不变的情况下,再向容器中通入CO、H2和CH3OH各0.5a mol,则平衡_______ (填“向右”、“向左”或“不”移动)。
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1- T2及T4- T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5molL﹣1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图. 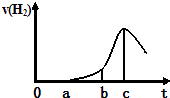
(1)下列关于图像的说法不正确的是(填序号,下同); ①a→b段产生H2加快可能是表面的氧化膜逐渐溶解,加快了反应速率
②b→c段产生H2较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生H2速率逐渐下降可能是铝片趋于消耗完全
(2)其他条件不变,现换用500mL 1molL﹣1盐酸,产生氢气速率普遍较使用500mL 0.5molL﹣1硫酸的快,可能的原因是; ①盐酸中c(H+)的浓度更大 ②Cl﹣有催化作用 ③SO42﹣有催化作用
④SO42﹣有阻化作用(使反应变慢) ⑤Al3+有催化作用
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②加入蒸馏水;③将铝片换成铝粉;④增加硫酸的浓度至18mol/L;⑤;⑥ . 以上方案不合理的有;请你再补充两种合理方案,填入空白⑤⑥处.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质变化的说法不正确的是( )
A. 石油的分馏和裂化都是化学变化 B. 硝化反应和酯化反应都属于取代反应
C. 煤的液化和气化都是化学变化 D. 乙烯与溴水反应和苯与H2反应都属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制备氢气时,下列措施不能使氢气生成速率加快的是( )
A.铁片改为铁粉 B.稀硫酸改为98% 浓硫酸
C.对该反应体系加热 D.铁片改为锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.滴定前用待测液润洗锥形瓶
B.容量瓶和滴定管使用前均需要检漏
C.蒸馏完毕时,先关闭冷凝水,再停止加热
D.分液时,上层溶液先从上口倒出,下层溶液再从下口放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列溶液中水的电离程度最小的是
A.0.01 mol/L 醋酸溶液B.0.01 mol/L NH4Cl 溶液
C.0.01 mol/L NaHSO4 溶液D.0.01 mol/L NaHCO3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
① 2H2(g)+O2(g)===2H2O(l)ΔH=-570.0 kJ·mol-1
②H2O(g)===H2(g)+![]() O2(g)ΔH= +241.8 kJ·mol-1
O2(g)ΔH= +241.8 kJ·mol-1
③C(s)+![]() O2(g)===CO(g)ΔH=-110.5 kJ·mol-1
O2(g)===CO(g)ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
回答下列各问题:
(1)上述反应中属于放热反应的是___________________。(填序号)
(2)H2的燃烧热ΔH=___________________;C的燃烧热ΔH=___________________。
(3)燃烧10 g H2生成液态水,放出的热量为___________________。
(4)如果需要释放787kJ的热量,需要完全燃烧____________________g的碳。
(5)CO的燃烧热ΔH=____,其热化学方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com