

A、母液中含有大量的Na+、NH
| ||||
B、通入NH3只是为了增加NH
| ||||
| C、加入的Y物质为CO2 | ||||
| D、生产过程中还需要补充水 |


科目:高中化学 来源: 题型:
| A、还原性:X的氢化物>Y的氢化物>Z的氢化物 |
| B、简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
| C、YX2、M2Y都是含有极性键的共价化合物 |
| D、Z元素的最高价氧化物的水化物的化学式为HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
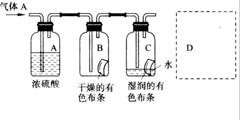 某学生用如图所示的方法研究物质的性质,其中气体A的主要成分,杂质是空气和水蒸气,回答下列问题:
某学生用如图所示的方法研究物质的性质,其中气体A的主要成分,杂质是空气和水蒸气,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①② | B、只有①②③ |
| C、只有①②③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 3 |
c(H
| ||
c(
|
| O | - 3 |
| O | 2- 3 |
| O | 2- 3 |
| O | - 3 |
| O | - 3 |
| O | - 3 |
| O | 2- 3 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com