
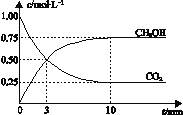
【题目】已知:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
A. 升高温度能使![]() 增大
增大
B. 反应达到平衡状态时,CO2的平衡转化率为75%
C. 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D. 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 molL-1min-1
【答案】B
【解析】
从勒夏特列原理、化学反应速率计算的角度进行分析。
A、该反应为放热反应,升高温度,平衡向逆反应方向进行,CH3OH物质的量减小,CO2的物质的量增大,该比值减小,故A错误;
B、根据图像,达到平衡时消耗c(CO2)=(1.00-0.25)mol·L-1=0.75mol·L-1,则CO2的转化率为0.75/1.00×100%=75%,故B正确;
C、3min时没有达到平衡,即CO2的表示的正反应速率不等于CH3OH表示的逆反应速率,故C错误;
D、根据化学反应速率数学表达式,v(CH3OH)=0.75/10mol/(L·min)=0.075mol/(L·min),根据化学反应速率之比等于化学计量数之比,即v(H2)=3v(CH3OH)=3×0.075mol/(L·min)=0.225mol/(L·min),故D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,不正确的是( )
A.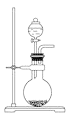 可用于实验室制取少量NH3或O2
可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
可用从a处加水的方法检验装置②的气密性
C.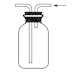 实验室可用装置③收集H2、NH3
实验室可用装置③收集H2、NH3
D.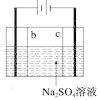 制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜
制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为xMg+Mo3S4![]() MgxMo3S4,下列说法正确的是( )
MgxMo3S4,下列说法正确的是( )
A.电池充电时,阴极发生还原反应生成Mo3S4
B.电池充电时,阳极反应为xMg-2xe-===xMg2+
C.电池放电时,Mg2+向负极迁移
D.电池放电时,正极反应为Mo3S4+2xe-+xMg2+=== MgxMo3S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种“全氢电池”的工作原理如图所示。下列说法正确的是
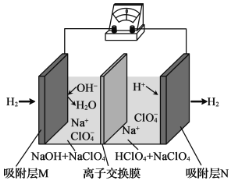
A. 电流方向是从吸附层M通过导线到吸附层N
B. 离子交换膜可阻止左边的碱性溶液和右边的酸性溶液发生中和
C. Na+从右边穿过离子交换膜向左边移动
D. 正极的电极反应是H2-2e-+2OH-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为: HUr(aq)+ Na+(aq) ![]() NaUr(s) + H+(aq) +Q (Q>0),下列说法错误的是
NaUr(s) + H+(aq) +Q (Q>0),下列说法错误的是
A.寒冷季节更易诱发关节疼痛
B.饮食中摄入过多食盐,会加重痛风病病情
C.大量饮水会增大痛风病发作的可能性
D.患痛风病的人应少吃能代谢产生更多尿酸钠的食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为氯碱工业的简易装置示意图,其中两电极均为惰性电极,下列说法正确的是
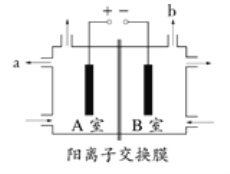
A.粗盐水中含有的少量Ca2+和Mg2+可用NaOH除去
B.阳离子交换膜允许Na+通过,而阻挡了Cl2进入B室
C.a处得到的是浓NaOH溶液
D.饱和食盐水从B室底部加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L氢气中含有2NA个中子
B. 0.1NA个氯化氢分子占有体积为2.24 L
C. 2克金属钙变成钙离子时失去的电子数为0.1NA
D. 50 mL 0.1 mol·L-1H2SO4溶液中含有H+数为0.005NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是_________________。
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在现代化工生产中,常利用FeCl3腐蚀铜的原理制作印刷线路板,写出该原理的化学方程式_________________________________。
(3)实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是_____________________ (用离子方程式表示)。
(4)某同学甲取2 mL FeSO4溶液,加入1滴KSCN溶液,再加入几滴氯水,溶液变红,说明Cl2可将Fe2+氧化。绿矾溶液与氯水反应的离子方程式为_______。
(5)同学乙认为甲同学的实验不够严谨,该同学在2 mL FeSO4 溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是_____________。
(6)为测定某绿矾FeSO4·xH2O中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g;将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g;按下图连接好装置进行实验:
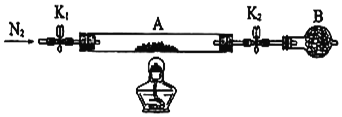
①仪器B的名称是____________。
②将下列实验操作步骤正确排序__________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却至室温
③根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水数目x=_______________________(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸,广泛分布于动植物体中。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一。有研究发现,EDTA(一种能结合金属离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因:_______________。
(2)已知:0.1 mol·L-1KHC2O4溶液呈酸性。下列说法正确的是_______(填字母序号)。
a. 0.1 mol·L-1KHC2O4溶液中:c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b. 0.1 mol·L-1KHC2O4溶液中:c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c. 浓度均为0.1 mol·L-1KHC2O4和K2C2O4的混合溶液中:2c(K+) = c(HC2O4-) + c(C2O42-)
d. 0.1 mol/L KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+) > c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
![]()
已知:i. pH>4时,Fe2+易被氧气氧化
ii. 几种物质的溶解度(g /100g H2O)如下
FeSO4·7H2O | (NH4)2SO4 | FeSO4·(NH4)2SO4·6H2O | |
20℃ | 48 | 75 | 37 |
60℃ | 101 | 88 | 38 |
①用稀硫酸调溶液pH至1~2的目的是:_____________,______________。
②趁热过滤的原因是:_______________。
③氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M)。称取a g草酸亚铁晶体溶于稀硫酸中,用b mol·L-1的高锰酸钾标准液滴定,到达滴定终点时,消耗高锰酸钾VmL,则M =__________。(已知:部分反应产物为Mn2+、Fe3+、CO2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com