
| A. | ①>②>③>④>⑤ | B. | ②>①>③>④>⑤ | C. | ②>③>④>①>⑤ | D. | ⑤>④>③>②>① |
分析 注意本题是判断溶液中的离子、分子总数,应包括溶质、溶剂以及由它们相互作用形成的离子.五瓶溶液溶质的浓度比较小,故主要取决于溶剂水的量,可以比较溶液体积分析判断.
解答 解:因溶液中的离子、分子总数,应包括溶质、溶剂以及由它们相互作用形成的离子,五瓶溶液溶质的浓度比较小,所以微粒数主要取决于溶剂水分子的量,可以用溶液体积直接判断,而溶液体积分别为10、20、30、40、50mL,依次增大.
故选D.
点评 本题考查了审题能力,若抓住了影响各瓶溶液所含离子分子总数的大小的主要因素,很容易求解.习惯上往往忽略溶剂只求溶质中的离子、分子总数而得出错误结论.要认真审题,这是一道反常规思维的题.


科目:高中化学 来源: 题型:选择题
| A. | 纯水100℃和25℃的pH值 | |
| B. | Na2CO3溶液中2c(CO32-)和c(Na+) | |
| C. | 100mL 0.1mol/L的CH3COOH溶液与10mL 1.0mol/L的CH3COOH溶液中H+数目 | |
| D. | 同温下pH=11的KOH与pH=3的CH3COOH溶液中由水电离出的OH-离子浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 皮肤上沾有苯酚可以用酒精清洗 | |
| B. | 502胶把手指粘到一起可以用丙酮溶解502胶 | |
| C. | 有机物都是能燃烧的 | |
| D. | 氟氯代烷可用作制冷剂、灭火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O的结构式H-O-H.
H2O的结构式H-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe2++3H2↑ | |
| B. | 碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+═Ca2++2CO2↑+2H2O | |
| C. | 醋酸与氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 硝酸银溶液与氯化钾溶液反应:Ag++Cl-═AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

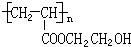 .
.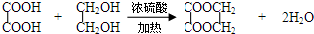 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、BaCl2、Na2CO3、HCl | B. | BaCl2、HCl、Na2CO3、NaOH | ||
| C. | BaCl2、Na2CO3、HCl、NaOH | D. | Na2CO3、NaOH、BaCl2、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
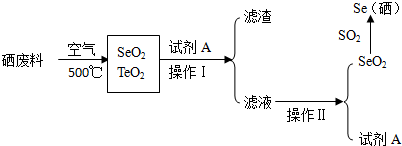
 | 沸点/℃ | 溶解性 |
| SeO2 | 684 | 易溶于水和乙醇 |
| TeO2 | 1260 | 微溶于水,不溶于乙醇 |
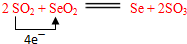 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com