
【题目】写出下列水溶液中的电离方程式或发生反应的离子方程式:
(1)小苏打溶于水___;
(2)用稀硫酸除掉镁条表面的氧化膜___;
(3)用胃舒平(有效成分是Al(OH) 3)治疗胃酸(主要成分是盐酸)过多___;
(4)用锌粉除去硫酸钾溶液中的Cd2+杂质(置换反应)___。
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸配制250mL0.1mol/L的盐酸溶液:
(1)配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为__。(保留小数点后一位)
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)配制物质的量浓度的溶液,造成浓度偏高的操作是___。(多选)
A.溶解后的溶液未冷至室温就转入容量瓶中;
B.洗涤烧杯和玻棒的溶液未转入容量瓶中;
C.定容时眼睛俯视刻度线;
D.定容时眼睛仰视刻度线;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:

请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用下图所示A~D中的装置进行混合物的分离和提纯,按要求回答下列问题:
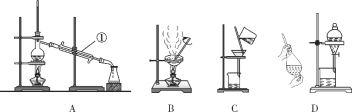
(1)仪器①的名称______________。
(2)除去Ca(OH)2溶液中悬浮的CaCO3颗粒应选用装置________(填字母代号,下同)。
(3)分离互溶的乙酸(沸点118 ℃)和乙酸乙酯(沸点77.1 ℃)的混合物应选用装置________。
(4)用CCl4提取碘水中的碘单质应选用装置________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图所示,是原电池的装置图。
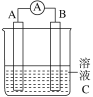
请回答:
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为________________________;反应进行一段时间后溶液C的pH将________(填“升高”“降低”或“基本不变”)
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
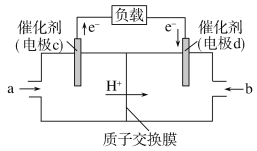
电池总反应为2CH3OH+3O2===2CO2+4H2O,
①则c电极是_______(填“正极”或“负极”),c电极的反应方程式为____________________________。
②若线路中转移2 mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为________L。
II.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
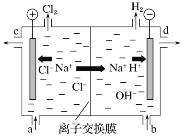
(1)写出电解饱和食盐水的离子方程式:____________________________________________。
(2)精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中______位置流出(选填“a”、“b”、“c”或“d”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、 Ba(NO3)2、NaCl、I2中的一种或几种混合而成,为检验它们做了如下实验:
a.将固体混合物溶于水后,搅拌后静置,得无色透明溶液和白色沉淀
b.过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解。依实验现象判断:
(1)固体混合物中肯定有___;肯定没有___。可能有的物质是___。
(2)上述b操作中沉淀全部溶解的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室要配制100 mL物质的量浓度为0.1mol/L的KMnO4溶液,回答问题:
(1)要配制上述溶液,所需仪器除天平、药匙、烧杯、玻璃棒、胶头滴管外,还需要___;
(2)根据计算,所需KMnO4固体的质量为___g(取小数点后两位);
(3)下列操作会导致所配溶液浓度偏低的是___(填选项代号)。
A.定容时加水超过刻度线,用胶头滴管吸出一些
B.定容时仰视刻度线
C.转移溶液后,没有洗涤烧杯内壁
D.配制前容量瓶内壁仍残留有蒸馏水
E.转移溶液时部分溶液溅出
Ⅱ.KMnO4是一种强氧化剂, 加酸酸化能够提高其氧化性,通常用硫酸酸化而不能用盐酸酸化,原因是KMnO4可以和盐酸发生反应。
(4)用双线桥法分析反应:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O___。该反应中,还原产物是___。
(5)若转移的电子数为0.4mol,则产生标况下气体体积为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图装置探究SO2的性质。

下列有关反应的方程式,不正确的是( )
A. ①中溶液显红色的原因: CO32-+ H2O![]() HCO3-+ OH-
HCO3-+ OH-
B. ①中溶液红色褪去的原因:2SO2 + CO32-+ H2O == CO2+ 2HSO3-
C. ②中溶液显黄绿色的原因:Cl2+ H2O == HCl + HClO
D. ②中溶液黄绿色褪去的原因:SO2+ Cl2 + 2H2O == H2SO4 + 2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生_____反应(填“氧化”或“还原”)。
(2)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。 “引火铁”是一种极细的铁粉,它在空气中可以自燃,其原因是_____________。
Ⅱ、在1 L 2 mol·L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示:
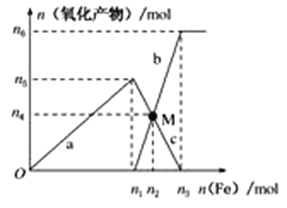
回答下列问题:
(1)写出加入n1mol铁所发生反应的离子方程式_______________________________。
(2)整个过程中转移电子的数目是________。
(3)若M点时再加入V L 2 mol·L-1的稀硝酸,恰好反应完全,则V为___________。
(4)研究表明硝酸的浓度越小,反应后氮的化合价越低。在极稀的硝酸溶液中加入少量铁粉,生成NH4+的离子方程式为___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com